Евра
- Список товарів
- Ціни в аптеках
Інструкція вказана для «Евра трансдермальний пластир №3»
Склад:
діючі речовини: 1 пластир площею 20 см2 містить норелгестромiну 6,0 мг, етинiлестрадiолу 0,60 мг; кожен пластир протягом 24 годин вивільняє 203 мкг норелгестромiну та 33,9 мкг етинілестрадіолу;
допомiжнi речовини: адгезивна суміш полiiзобутилену та полiбутену, лауриллактат, кросповiдон.
Лікарська форма. Пластир – трансдермальна терапевтична система (ТТС).
Основні фiзико-хiмiчнi властивостi: квадратна трансдермальна система з матовою основою тілесного кольору, заокругленими кутами, прозорою плівкою, що видаляється, та безбарвним клейовим (адгезивним) шаром. Система упакована у непрозорий білий пакет, на який нанесено вiдповiдне маркування.
Фармакотерапевтична група. Гормональні контрацептиви для системного застосування.
Код АТХ G03А А13.
Фармакологiчнi властивостi.
Фармакодинамiка.
Евра® – контрацептив, що запобiгає заплiдненню завдяки механiзму пригнiчення гонадотропiнiв шляхом естрогенної i прогестагенної дiї етинiлестрадiолу та норелгестромiну. Первинний механiзм дiї полягає в iнгiбуваннi овуляцiї, але змiни цервiкального слизу та ендометрiя також можуть посилювати ефективнiсть препарату.
Таблиця 1
Індекси Перля
|
Досліджувальна група |
СONT-002 Евра® |
СONT-003 Евра® |
СONT-002 КПК* |
СONT-002 Евра® |
СONT-002 КПК** |
Всі пацієнти Евра® |
|
Кількість циклів |
10743 |
5831 |
4592 |
5095 |
4005 |
21669 |
|
Індекс Перля (ДІ 95 %) Загальний |
0,73 (0,15–1,31) |
0,89 (0,02–1,76) |
0,57 (0,0–1,35) |
1,28 (0,16–2,39) |
2,27 (0,59–3,96) |
0,90 (0,44–1,35) |
|
Індекс Перля (ДІ 95 %) Помилка методу |
0,61 (0,0–1,14) |
0,67 (0,0–1,42) |
0,28 (0,0–0,84) |
1,02 (0,02–2,02) |
1,30 (0,03–2,57) |
0,72 (0,31–1,13) |
* Дезогестрел 150 мкг + етинілестрадіол (ЕЕ) 20 мкг.
** Левоноргестрел 50 мкг + ЕЕ 30 мкг 1–6 дні, левоноргестрел 75 мкг + ЕЕ 40 мкг 7–11 дні, левоноргестрел 125 мкг + ЕЕ 30 мкг 12–21 дні.
Для визначення, чи пов’язані з вагітністю популяційні характеристики віку, раси та маси тіла, було проведено дослідницькі аналізи в дослідженнях III фази (n = 3319). Аналізи не показали ніякого зв’язку віку та раси пацієнтки з вагітністю. Щодо маси тіла, то 5 із 15 вагітностей, про які повідомлялося при застосуванні препарату Евра®, були у жінок, початкова маса тіла яких дорівнювала або перевищувала 90 кг, що становило < 3 % досліджуваної популяції. При масі тіла менше 90 кг зв’язку між масою тіла та вагітністю не було. Хоча лише 10–20 % варіабельності фармакокінетичних даних можна пояснити масою тіла (див. розділ «Фармакокінетика»), більша частка вагітностей у жінок із масою тіла 90 кг або більше була статистично значущою, що вказує на те, що Евра® менш ефективний у цих жінок.
При застосуванні більш високих доз КПК (50 мкг етинілестрадіолу) знижується ризик раку ендометрія та яєчників. Чи це також стосується комбінованих гормональних контрацептивів із меншою дозою, ще належить підтвердити.
Фармакокiнетика.
Абсорбцiя. Рiвноважна концентрацiя (плато) норелгестромiну та етинiлестрадiолу у сироватцi крові досягається приблизно через 48 годин пiсля аплiкацiї пластиру (ТТС) Евра®. Стабiльний рівень концентрацiї норелгестромiну та етинiлестрадiолу протягом 1 тижня застосування пластиру становить майже 0,8 нг/мл i 50 пг/мл вiдповiдно. У дослідженнях багаторазових доз трансдермального пластиру (ТТС) Евра® сироваткові концентрації (Css) i AUC незначною мiрою збiльшуються вiдносно концентрацiй на 1-му тижнi 1-го циклу.
Абсорбція норелгестоміну та етинілестрадіолу після наклеювання пластиру (ТТС) Евра® досліджувалися в умовах спортивного клубу (сауна, джакузі, бігова доріжка та інші вправи з аеробіки), а також у ванні з холодною водою. Результати свідчили, що для норелгестроміну не було суттєвих змін у Css i AUC порівняно з такими при звичайному способі життя. Для етинілестрадіолу ці значення дещо збільшувалися при фізичному навантаженні; однак рівень Css був у межах референтних значень. Холодна вода не впливала на ці параметри.
Результати дослідження застосування одного контрацептивного трансдермального пластиру (ТТС) Евра® впродовж 7 днів та 10 днів показали, що цiльовi значення Css норелгестромiну та етинiлестрадiолу пiдтримувалися протягом 3 днiв продовженого застосування пластиру (ТТС) Евра® (10 днiв), тобто клiнiчна ефективнiсть ТТС зберiгається, навіть якщо жiнка проведе чергову замiну пластиру (ТТС) Евра® на 2 повних днi пiзнiше запланованого терміну.
Розподiл. Норелгестромiн i норгестрел (сироватковий метаболiт норелгестромiну) мають високий ступiнь (> 97 %) зв’язування з бiлками сироватки крові. Норелгестромiн зв’язується з альбумiном, норгестрел – переважно з глобулiнами, що зв’язують статеві гормони. Етинiлестрадiол має високий ступiнь зв’язування з сироватковим альбумiном.
Бiотрансформацiя. Норелгестромiн метаболiзується у печiнцi з утворенням метаболiту норгестрелу, що переважно зв’язується з глобулiном, що зв’язує статеві гормони (ГЗСГ), а також рiзних гiдроксильованих i кон’югованих метаболiтiв. Етинiлестрадiол метаболiзується до рiзних гiдроксильованих продуктiв i їх глюкуронiдiв та сульфатних кон’югатiв.
Елiмiнацiя. Після зняття пластиру середнiй перiод напiввиведення норелгестромiну та етинiлестрадiолу становить майже 28 годин i 17 годин вiдповiдно. Метаболiти норелгестромiну та етинiлестрадiолу елiмiнуються з сечею та калом.
Трансдермальнi та пероральні контрацептивні засоби. Фармакокiнетичнi профiлi трансдермальних i пероральних комбiнованих контрацептивiв рiзнi, i слiд дотримуватися обережностi при методi прямого спiвставлення фармакокiнетичних параметрiв. У ході порiвняння пластиру (ТТС) Евра® та пероральних контрацептивiв, що мiстили норгестимат (попередник норелгестромiну) 250 мкг/етинiлестрадiол 35 мкг, значення Сmax були у 2 рази вищі для НГМН та ЕЕ у пiддослiдних, якi приймали пероральнi контрацептиви, порiвняно з відповідними показниками у групі Евра®, тодi як загальна експозицiя (AUC та Css) були подiбними у пiддослiдних, якi застосовували пластир (ТТС) Евра®. Мiжсуб’єктна варiабельнiсть (% СV) для фармакокiнетичних параметрiв доставки норелгестромiну та етинiлестрадiолу вiд пластиру (ТТС) Евра® була вище вiдносно варiабельностi, встановленої вiд пероральних контрацептивiв.
Вплив віку, маси тіла і площі поверхні тіла
Вплив вiкy, маси тiла i площi поверхнi тiла на фармакокiнетику норелгестромiну та етинiлестрадiолу вивчали з участю 230 жiнок у ході 9 фармакокiнетичних дослiджень разового 7-денного застосування пластиру (ТТС) Евра®. Значения Css i AUC норелгестромiну і етинiлестрадiолу незначною мiрою знижуються зi збiльшенням віку, маси тiла i площi поверхнi тiла. Однак лише мала частина (10-20 %) загальної варiабельностi фармакокiнетики норелгестромiну та етинiлестрадiолу наступного застосування пластиру (ТТС) Евра® може бути пов’язана з одним iз вищезазначених параметрiв.
Клiнiчнi характеристики.
Показання.
Контрацепція у жінок.
Евра® показаний до застосування жінкам репродуктивного віку. Безпека та ефективність пластиру ТТС Евра® встановлені лише для жінок віком від 18 до 45 років.
Рішення про призначення препарату Евра® повинно враховувати поточні фактори ризику для кожної жінки, особливо щодо венозної тромбоемболії (ВТЕ), з урахуванням ризику венозної тромбоемболії (ВТЕ) при застосуванні Евра® у порівнянні з іншими комбінованими гормональними контрацептивами (КГК) (див. розділи «Протипоказання», «Особливості застосування»).
Протипоказання.
Комбіновані гормональні контрацептиви (КГК) не можна застосовувати при наявності одного з нижченаведених станів. Якщо будь-який з цих станів виникає під час застосування лікарського засобу Евра®, його застосування слід негайно припинити.
• Венозна тромбоемболія (ВТЕ) або ризик її розвитку:
- венозна тромбоемболія (з лікуванням антикоагулянтами) або ВТЕ в анамнезі [тромбоз глибоких вен (ТГВ) або емболія легень (ЕЛ)];
- cпадкова або набута схильність до венозної тромбоемболії, наприклад резистентність до активованого протеїну С (включаючи фактор V Ляйдена), недостатність антитромбіну ІІІ, протеїну С, протеїну S;
- обширне оперативне втручання з тривалою іммобілізацією (див. розділ «Особливості застосування»);
- підвищений ризик венозної тромбоемболії внаслідок наявності множинних факторів ризику (див. розділ «Особливості застосування»).
• Артеріальна тромбоемболія (АТЕ) або ризик її розвитку:
- артеріальна тромбоемболія, у тому числі в анамнезі (наприклад, інфаркт міокарда), або продромальна стадія тромбозу (наприклад, стенокардія);
- цереброваскулярні захворювання: гострі порушення мозкового кровообігу, інсульт в анамнезі або продромальна стадія тромбозу (наприклад, транзиторна ішемічна атака);
- спадкова або набута схильність до артеріального тромбозу, наприклад гіпергомоцистеїнемія та антифосфоліпідні антитіла (антикардіоліпін-антитіла, вовчаковий антикоагулянт);
- мігрень з фокальними неврологічними симптомами в анамнезі;
- підвищений ризик артеріальної тромбоемболії внаслідок наявності множинних факторів ризику (див. розділ «Особливості застосування») або одного з перелічених нижче серйозних факторів ризику:
• цукровий діабет із судинними симптомами;
• тяжка артеріальна гіпертензія;
• тяжка дисліпопротеїнемія.
• Підвищена чутливість до діючих речовин препарату або до будь-якої з допоміжних речовин.
• Підтверджена або підозрювана карцинома молочних залоз.
• Рак ендометрія або інші підтверджені або підозрювані естрогензалежні новоутворення.
• Порушення функції печінки внаслідок гострої або хронічної гепатоцелюлярної хвороби.
• Аденома або карцинома печінки.
• Недіагностована генітальна кровотеча.
• Одночасне застосування з лікарськими засобами, що містять омбітасвір/паритапревір/ритонавір та дасабувір, лікарськими засобами, що містять глекапревір/пібрентасвір або софосбувір/велпатасвір/воксилапревір (див. розділ «Взаємодія з іншими лікарськими засобами та iншi види взаємодій»).
Особливі заходи безпеки.
Одразу після видалення пластиру (ТТС) Евра® iз пакетика його слід щільно приклеїти до шкіри.
Для запобігання погіршенню адгезивних властивостей пластиру (ТТС) Евра® не слід застосовувати креми, лосьйони або порошки на ділянку шкіри, де планується застосування пластиру.
Після зняття пластир ще містить значну кiлькiсть активних речовин. 3алишковi гормони можуть зашкодити навколишньому середовищу у разі їх потрапляння у воду, тому використані пластири (ТТС) Евра® слід обережно утилізувати. Для цього відокремити липку стрічку iз зовнішнього боку пакетика. Використаний пластир (ТТС) Евра® слід помістити у пакетик таким чином, щоб його липка поверхня була обернена до зафарбованої зони пакетика, i, злегка притиснувши, заклеїти. Будь-який невикористаний матеріал або відходи мають бути утилізовані згідно з місцевими вимогами. Використані пластири (ТТС) Евра® не можна викидати в унітаз або каналiзацiю.
Взаємодія з іншими лікарськими засобами та iншi види взаємодій.
Слід ознайомитися з інструкцією для медичного застосування супутнього лікарського засобу для визначення можливих взаємодій.
Фармакодинамічні взаємодії
Під час клінічних досліджень за участю пацієнтів, які отримували лікарські засоби для лікування інфекцій вірусного гепатиту С (HCV), що містять омбітасвір/паритапревір/ритонавір і дасабувір з рибавірином або без нього, було виявлено підвищення трансамінази (АЛТ) більше ніж у 5 разів вище верхньої межі норми (ВМН). Це відбувалося зі значно більшою частотою у жінок, які застосовували лікарські засоби, що містять етинілестрадіол, зокрема і комбіновані гормональні контрацептиви (КГК). Крім того, також у разі лікування глекапревіром/пібрентасвіром або софосбувіром/велпатасвіром/воксилапревіром спостерігалося підвищення АЛТ у жінок, які приймали лікарські засоби, що містять етинілестрадіол, такі як КГК (див. розділ «Протипоказання»). Тому жінки, які використовують Евра®, повинні почати застосовувати альтернативні методи контрацепції (наприклад, контрацептиви, що містять тільки прогестагени або негормональні методи контрацепції), до того як розпочати лікування за цією схемою. Застосування Евра® можна розпочати знову через 2 тижні після завершення лікування за цією комбінованою схемою.
Вплив інших лікарських засобів на Евра®
Можуть спостерігатися взаємодії з лікарськими засобами, які посилюють дію печінкових ензимів, що призводить до збільшення кліренсу статевих гормонів, що, в свою чергу, може призвести до проривної кровотечі та/або втрати контрацептивного ефекту. Були описані нижчезазначені взаємодії.
Лікарські засоби, що збільшують кліренс КГК (знижена ефективність КГК, спричинена індукцією ферментів): барбітурати, бозентан, карбамазепін, фенітоїн, примідон, рифампіцин, модафініл, ВІЛ-препарати ритонавір, невірапін, ефавіренц та, можливо, фелбамат, гризеофульвін, окскарбазепін, топірамат і продукти, що містять екстракт звіробою (Hypericum perforatum).
Управління ризиками
Підвищення рівня ферментів може спостерігатися через декілька днів після початку лікування. Максимальна активація ферментів загалом проявлялася протягом 10 днів та потім трималася протягом 4 тижнів після припинення терапії.
Короткострокове лікування
Жінки, які проходять короткострокове лікування будь-якими із зазначених класів лікарських засобів або окремих активних речовин, що індукують печінкові ферменти, повинні тимчасово використовувати бар’єрний метод захисту додатково до Евра® протягом одночасного застосування лікарського засобу та 28 днів після його припинення.
Якщо одночасний прийом лікарського препарату продовжується після закінчення одного тижня застосування пластиру, наступний трансдермальний пластир потрібно приклеїти без звичайної перерви у його застосуванні.
Довгострокове лікування
Жінкам, які проходять довгострокове лікування будь-якими із зазначених класів лікарських засобів, рекомендується застосовувати інший надійний негормональний спосіб контрацепції.
Лікарські засоби, що впливають на кліренс КГК
При одночасному застосуванні з КГК різноманітні комбінації інгібіторів протеази ВІЛ та ненуклеозидних інгібіторів зворотної транскриптази (ННІЗТ), включаючи комбінації препаратів для лікування інфекції вірусу гепатиту С (ВГС), можуть підвищувати або знижувати концентрацію естрогену та прогестинів у плазмі крові. У деяких випадках результат таких змін концентрації може бути клінічно важливим.
Тому перед одночасним застосуванням слід ознайомитися з інструкціями для медичного застосування лікарських засобів для лікування ВІЛ-інфекції в частині можливих взаємодій та пов’язаних з ними рекомендацій щодо застосування. При виникненні сумнівів жінкам, які застосовують інгібітори протеази або ненуклеозидні інгібітори зворотної транскриптази (ННІЗТ), слід застосовувати додатковий бар’єрний метод контрацепції.
Пригнічення метаболізму етинілестрадіолу
Еторикоксиб проявив підвищення рівня ЕЕ у плазмі крові (на 50-60 %) при одночасному прийомі з пероральними трифазними гормональними контрацептивами. Вважається, що еторикоксиб підвищує рівні ЕЕ за рахунок пригнічення активності сульфотрансферази, таким чином пригнічуючи метаболізм ЕЕ.
Вплив Евра® на інші лікарські засоби
Гормональні контрацептиви можуть впливати на метаболізм деяких інших активних речовин. Відповідно, концентрації у плазмі крові та тканинах можуть підвищитися (наприклад, циклоспорину). Може виникнути необхідність у регулюванні дозування супутнього лікарського засобу.
Ламотриджин: комбіновані гормональні контрацептиви значно знижують концентрації ламотриджину у плазмі крові при одночасному застосуванні за рахунок індукції глюкуронідації ламотриджину. Це може знижувати терапевтичний ефект; може знадобитися корекція дози ламотриджину.
Лабораторні показники
Застосування гормональних контрацептивів може вплинути на результати деяких лабораторних аналізів, включаючи біохімічні показники печінки, щитовидної залози, надниркових залоз та нирок, рівень білків (переносників) у плазмі крові, наприклад, кортикостероїдзв’язуючого глобуліну та фракції жирів/ліпопротеїдів, параметри метаболізму вуглеводів та параметри коагуляції та фібринолізу. Зміни загалом залишаються у межах лабораторних норм.
Особливості застосування.
Якщо присутній будь-який із зазначених нижче станів/факторів ризику, слід розглянути користь від застосування лікарського засобу Евра® та можливі ризики для кожної жінки індивідуально та обговорити з жінкою перед тим, як вона вирішить розпочати застосовувати пластир Евра®.
Жінці слід пояснити, що у разі погіршення, загострення або появи одного з цих станів або факторів ризику їй необхідно звернутися до лікаря, який вирішить, чи варто припиняти застосування препарату.
Немає клінічних доказів того, що трансдермальний пластир у будь-якому аспекті є безпечнішим за комбіновані пероральні контрацептиви.
Лікарський засіб Евра® не показаний у період вагітності (див. розділ «Застосування у перiод вагiтностi або годування груддю»).
Ризик венозної тромбоемболії (ВТЕ)
Застосування будь-якого комбінованого гормонального контрацептиву підвищує ризик венозної тромбоемболії порівняно з тим, коли такі препарати не застосовують. Засоби, які містять левоноргестрел, норгестимат або норетистерон асоціюються з найменшим ризиком ВТЕ. Інші засоби, такі як Евра®, можуть мати вдвічі вищий рівень ризику розвитку ВТЕ. Рішення про застосування лікарського засобу слід приймати тільки після обговорення з жінкою, впевнившись у тому, що вона усвідомлює ризик розвитку ВТЕ при застосуванні пластиру Евра® і розуміє, як наявні у неї фактори ризику впливають на цей ризик і що ризик ВТЕ є найвищим протягом першого року використання пластиру. Існують також деякі свідчення того, що ризик зростає, коли комбіновані пероральні контрацептиви (КПК) призначають повторно після перерви у використанні 4 тижні і більше.
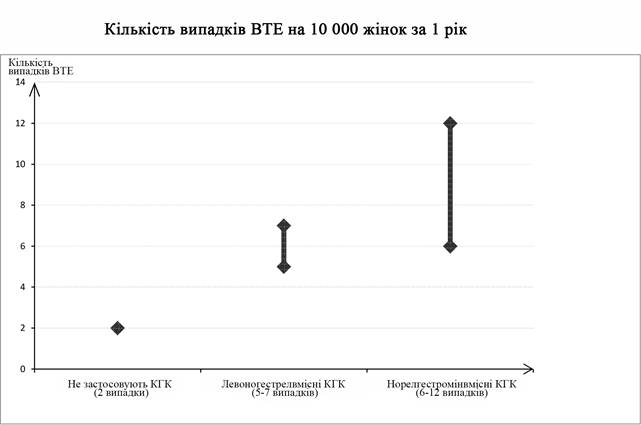
Приблизно у 2 з 10 000 жінок, які не застосовують КГК і не вагітні, розвивається ВТЕ протягом 1 року. Проте у кожної жінки цей ризик може бути набагато вищим залежно від наявних у неї факторів ризику (див. нижче).
Встановлено, що з 10 000 жінок, які застосовують низькі дози КГК, що містять левоногестрел, приблизно у 61 розвивається ВТЕ протягом 1 року. Згідно з дослідженнями частота розвитку ВТЕ у жінок, що застосовують пластир Евра® становить приблизно 6-12 випадків на 10000 жінок на рік, що вдвічі вище, ніж у жінок, які застосовуюсь КГК, що містять левоноргестрел.
Кількість випадків ВТЕ на рік при застосуванні КГК є нижчою, ніж кількість випадків ВТЕ, що розвивається у жінок під час вагітності або у післяпологовий період.
ВТЕ може мати летальний наслідок у 1-2 % випадків.
1 Медіана діапазону від 5 до 7 на 10 000 жінко-років встановлена за відносним ризиком при застосуванні КГК, що містять левоногестрел, в порівнянні з незастосуванням засобу - від 2,3 до 3,6.
Дуже рідко повідомлялося про випадки тромбозу інших кровоносних судин, наприклад печінкової, брижової, ниркової вен або вен/артерій сітківки, серед жінок, які застосовували КГК.
Фактори ризику ВТЕ
Ризик розвитку венозних тромбоемболічних ускладнень у жінок, що застосовують КГК, значно підвищується при наявності додаткових факторів ризику, особливо множинних (див. таблицю 2).
Застосування пластиру Евра® протипоказане жінкам, які мають множинні фактори ризику розвитку венозного тромбозу (див. розділ «Протипоказання»). Якщо жінка має більше ніж один фактор ризику, не виключено, що загальний ризик є більшим, ніж сума окремих факторів – у цьому випадку слід зважити загальний ризик ВТЕ у жінки. Якщо співвідношення ризику та користі вважається негативним, КГК не слід призначати (див. розділ «Протипоказання»).
Таблиця 2
Фактори ризику ВТЕ
|
Фактор ризику |
Коментар |
|
Надмірна маса тіла (індекс маси тіла більше 30 кг/м2) |
Ризик значно підвищується при збільшенні індексу маси тіла. Особливо важливо враховувати наявність інших факторів ризику. |
|
Довготривала іммобілізація, обширні оперативні втручання, операції на нижніх кінцівках або тазу, нейрохірургія, серйозні травми. Примітка: тимчасова іммобілізація, включаючи авіа перельоти тривалістю > 4 годин, також може бути фактором ризику ВТЕ, особливо у жінок з іншими факторами ризику. |
У таких випадках рекомендується припинити застосування пластиру (у випадку планової операції – щонайменше за 4 тижні до втручання) та не продовжувати поки не мине 2 тижні з моменту повного відновлення рухів. Слід використовувати інший метод контрацепції для попередження небажаної вагітності. Слід розглянути необхідність застосування антикоагулянтів якщо застосування пластиру Евра® не було припинене завчасно. |
|
Обтяжений сімейний анамнез (наприклад, венозна тромбоемболія у брата/сестри або батьків у відносно молодому віці). |
При підозрі на спадкову схильність жінка повинна звернутися за порадою до спеціаліста перед прийняттям рішення щодо застосування комбінованих гормональних контрацептивів. |
|
Інші медичні стани, асоційовані з ВТЕ |
Злоякісна пухлина, системний червоний вовчак, гемолітичний уремічний синдром, хронічні запальні захворювання кишечнику (наприклад, хвороба Крона або виразковий коліт), серповидноклітинна анемія. |
|
Збільшення віку |
Особливо понад 35 років. |
Не існує загальноприйнятої думки щодо можливої ролі варикозу вен та поширеного тромбофлебіту в етіології венозної тромбоемболії.
Слід брати до уваги підвищений ризик тромбоемболії під час вагітності, і особливо протягом 6-тижневого періоду після пологів (для додаткової інформації див. розділ «Застосування у період вагiтностi або годування груддю»).
Симптоми ВТЕ (тромбоз глибоких вен та емболія легень)
Жінки, які застосовують комбіновані контрацептиви, повинні негайно повідомити лікаря про появу симптомів тромбозу.
Симптоми тромбозу глибоких вен (ТГВ) включають:
- односторонній набряк ноги та/або стопи або набряк уздовж вени на нозі;
- біль або болісні відчуття в нозі, які відчуваються тільки при стоянні і ходьбі;
- підвищену температуру ураженої ноги, почервоніння або блідість шкіри ноги.
Симптоми емболії легень (ЕЛ) включають:
- раптове порушення дихання або прискорене дихання;
- раптовий кашель, який може супроводжуватися кровохарканням;
- різкий біль у грудях;
- переднепритомний стан або запаморочення;
- швидке або нерегулярне серцебиття.
Деякі з цих симптомів є неспецифічними (наприклад, порушення дихання, кашель) і можуть бути прийняті за ознаки іншого більш поширеного і менш тяжкого стану (наприклад, інфекції дихальних шляхів).
Інші ознаки оклюзії судин включають: раптовий біль, набряк і незначне посиніння кінцівки.
Якщо оклюзія відбувається у судинах ока, симптоми можуть варіювати від безболісного погіршення зору до його втрати. Іноді втрата зору відбувається майже моментально.
Ризик артеріальної тромбоемболії (АТЕ)
Епідеміологічні дослідження пов’язують використання КГК з підвищеним ризиком артеріальної тромбоемболії (інфаркт міокарда) або порушенням мозкового кровообігу (наприклад, транзиторна ішемічна атака, інсульт). Артеріальна тромбоемболія може мати летальний наслідок.
Фактори ризику АТЕ
Ризик артеріальних тромбоемболічних ускладнень або порушення мозкового кровообігу у пацієнтів, які застосовують КГК, збільшується у жінок з факторами ризику (див. таблицю 3). Застосування пластиру Евра® протипоказане жінкам, які мають серйозні або множинні фактори ризику розвитку ATE (див. розділ «Протипоказання»). Якщо жінка має більше ніж один фактор ризику, не виключено, що загальний ризик є більшим, ніж сума окремих факторів – у цьому випадку слід зважити загальний ризик АТЕ у жінки. Якщо співвідношення ризику та користі вважається негативним, КГК не слід призначати (див. розділ «Протипоказання»).
Таблиця 3
Фактори ризику АТЕ
|
Фактор ризику |
Коментар |
|
Збільшення віку |
Особливо понад 35 років. |
|
Паління |
Жінкам настійно рекомендується не палити, якщо вони хочуть застосовувати КГК. Жінкам віком від 35 років, які продовжують палити, рекомендовано застосовувати інші методи контрацепції. |
|
Гіпертензія |
|
|
Надмірна маса тіла (індекс маси тіла більше 30 кг/м2) |
Ризик значно підвищується при збільшенні індексу маси тіла. Особливо важливо враховувати наявність інших факторів ризику. |
|
Обтяжений сімейний анамнез (наприклад, артеріальна тромбоемболія у брата або у батьків у відносно молодому віці, тобто менше 50 років). |
При підозрі на спадкову схильність жінка повинна звернутися за порадою до спеціаліста перед прийняттям рішення щодо застосування гормональних контрацептивів. |
|
Мігрень |
Збільшення частоти або тяжкості випадків мігрені під час застосування КГК (що може бути продромальним станом порушення мозкового кровообігу) може бути причиною негайного припинення застосування пластиру. |
|
Інші медичні стани, асоційовані з небажаними судинними порушеннями |
Цукровий діабет, гіпергомоцистеїнемія, захворювання клапанів серця та миготлива аритмія, дисліпопротеїнемія, системний червоний вовчак. |
Симптоми АТЕ
Жінки, які застосовують комбіновані контрацептиви, повинні негайно повідомити лікаря при появі симптомів АТЕ.
Симптоми порушення мозкового кровообігу включають:
- раптова слабкість або оніміння обличчя, руки або ноги, особливо на одній стороні тіла;
- раптове утруднення ходьби, запаморочення, втрата рівноваги або координації;
- раптова сплутаність свідомості, проблеми з мовою або розумінням;
- раптові проблеми із зором одного або обох очей;
- раптовий, сильний або тривалий головний біль без певної причини;
- втрата свідомості або непритомність з конвульсіями або без.
Тимчасові симптоми дозволяють підозрювати транзиторну ішемічну атаку.
Симптоми інфаркту міокарда включають:
- біль, дискомфорт, тиск, тяжкість, відчуття здавлювання або розпирання в грудях, руці, або нижче грудини;
- дискомфорт з іррадіацією в спину, щелепу, горло, руки, живіт;
- відчуття переповнення шлунку, розладу шлунка або задуха;
- пітливість, нудота, блювота і запаморочення;
- сильна слабкість, занепокоєння або задишка;
- швидке або нерегулярне серцебиття.
Жінки, які застосовують комбіновані контрацептиви, повинні негайно повідомити лікаря про можливі симптоми тромбозу. У випадку підозрюваного або підтвердженого тромбозу прийом гормональних контрацептивів необхідно припинити. Адекватну контрацепцію потрібно розпочати через тератогенність антикоагулянтної терапії (кумарини).
Пухлини
У ході деяких епідеміологічних досліджень повідомлялося про підвищений ризик розвитку раку шийки матки при довготривалому застосуванні КПК, але досі не встановлено, наскільки це відкриття залежить від поєднання впливу статевої поведінки та інших факторів, таких як вірус папіломи людини (ВПЛ).
Метааналіз 54 епідеміологічних досліджень показав, що існує дещо підвищений ризик (відносний ризик=1,24) виникнення раку грудей у жінок, які приймають КПК. Ризик поступово зменшується протягом 10 років після припинення застосування КПК. Оскільки рак грудей є рідкісним серед жінок віком до 40 років, кількість діагнозів раку грудей у осіб, які застосовували або застосовують КПК, є малою порівняно із загальним ризиком раку грудей. Рак молочної залози, діагностований у постійних користувачів КПК, як правило, менш клінічно поширений, ніж у жінок, які ніколи не приймали контрацептиви.
Підвищений ризик може бути пов’язаний з ранньою діагностикою раку грудей серед пацієнтів, які застосовують КПК, біологічними ефектами КПК або з комбінацією обох причин.
Рідко повідомлялося про доброякісні пухлини печінки та ще рідше про злоякісні пухлини печінки серед пацієнтів, які застосовували КПК. В окремих випадках ці пухлини призвели до внутрішньочеревних кровотеч, що загрожували життю. Таким чином, слід проводити диференціальну діагностику з печінковою пухлиною при скаргах на гострий біль у животі, збільшенні печінки та ознаках внутрішньочеревної кровотечі у жінок, які застосовували лікарський засіб Евра®.
Розлади з боку психіки
Відомими побічними ефектами застосування гормональних контрацептивів є пригнічення настрою та депресія (див. розділ «Побічні реакції»). Депресія може бути тяжкою і є добре відомим фактором ризику суїцидальної поведінки та суїциду. Жінок слід проінструктувати про необхідність звернутися до лікаря у разі виникнення змін настрою та симптомів депресії, включно з такими, що виникли невдовзі після початку застосування КПК.
Інші стани
Контрацептивна ефективність може бути знижена у жінок, маса тіла яких становить або перевищує 90 кг (див. розділи «Спосіб застосування та дози» та «Фармакодинаміка»).
Жінки з гіпертригліцеридемією або з такими випадками у сімейному анамнезі мають підвищений ризик розвитку панкреатиту при застосуванні комбінованих гормональних контрацептивів.
Хоча незначне підвищення артеріального тиску спостерігалося у багатьох жінок, які приймали гормональні контрацептиви, клінічно суттєве підвищення спостерігалося рідко. Зв’язок між застосуванням гормональних контрацептивів та клінічною артеріальною гіпертензією не був встановлений. Якщо під час застосування комбінованих гормональних контрацептивів на тлі існуючої артеріальної гіпертензії спостерігається постійне або значне підвищення артеріального тиску, яке не відповідає на антигіпертензивне лікування, застосування комбінованих гормональних контрацептивів потрібно припинити. Комбіновані гормональні контрацептиви можна знову застосовувати, якщо антигіпертензивна терапія забезпечує контроль нормального рівня артеріального тиску.
Такі стани з’являлися або погіршувалися або у період вагітності, або при застосуванні КПК, але докази зв’язку з застосуванням КПК непереконливі: жовтяниця та/або свербіж, пов’язаний з холестазом; захворювання жовчного міхура, включаючи холецистит і жовчнокам’яну хворобу; порфірія; системний червоний вовчак; гемолітичний уремічний синдром; хорея Сиденхама; герпес вагітних; втрата слуху, пов’язана з отосклерозом.
Гострі та хронічні порушення печінкової функції можуть потребувати припинення комбінованої гормональної контрацепції до моменту, коли печінкові маркери повернуться до норми. Рецидив свербежу, пов’язаного з холестазом, що виник у період попередньої вагітності або попереднього застосування статевих стероїдів, потребує припинення прийому комбінованих гормональних контрацептивів.
Незважаючи на те, що комбіновані гормональні контрацептиви можуть вплинути на периферичну інсулінорезистентність та переносимість глюкози, немає доказів необхідності зміни терапевтичного режиму при цукровому діабеті у період застосування гормональних контрацептивів. Однак жінки, хворі на цукровий діабет, повинні постійно перебувати під контролем лікарів, особливо на ранніх стадіях застосування лікарського засобу Евра®.
Під час застосування КПК повідомлялося про ускладнення ендогенної депресії, епілепсії, хвороби Крона або виразкового коліту.
Екзогенні естрогени можуть індукувати або посилювати симптоми спадкового та набутого ангіоневротичного набряку.
Хлоазма може виникнути при застосуванні гормональних контрацептивів, особливо у жінок з хлоазмою вагітних в анамнезі. Пацієнти зі схильністю до хлоазми повинні уникати сонця або УФ опромінення при застосуванні Евра®. Хлоазма часто є необоротною.
Медичний огляд/консультація
Перед початком або поновленням прийому Евра® необхідно розглянути повну історію хвороби (включаючи сімейний анамнез) та виключити вагітність. Потрібно виміряти артеріальний тиск та провести фізичний огляд для встановлення наявності протипоказань (див. розділ «Протипоказання») та попереджень (див. розділ «Особливості застосування»). Важливо звернути увагу жінки на інформацію щодо венозного та артеріального тромбозу, у тому числі щодо ризику застосування пластиру Евра® у порівнянні з іншими КГК, симптоми ВТЕ і ATE, відомі фактори ризику та поведінки у разі підозри на тромбоз.
Жінка має бути проінструктована уважно ознайомитися з інструкцією до медичного застосування лікарського засобу та дотримуватись наданих рекомендацій. Частота та обсяг наступних медичних оглядів мають бути встановлені відповідно до існуючої клінічної практики та клінічного стану жінки.
Жінці потрібно повідомити про те, що гормональні контрацептиви не захищають від ВІЛ-інфекції (СНІД) та інших хвороб, що передаються статевим шляхом.
Порушення режиму кровотеч
Як і при застосуванні інших комбінованих гормональних контрацептивів, упродовж перших місяців застосування можуть спостерігатися нерегулярні кровотечі (мажучі виділення або проривні кровотечі). Тому консультація спеціаліста може бути корисною лише після періоду звикання тривалістю приблизно 3 цикли. Якщо проривні кровотечі зберігаються постійно або виникають після регулярної кровотечі у попередніх циклах при застосуванні лікарського засобу Евра® відповідно до рекомендацій, потрібно розглянути існування іншої причини. Слід звернути увагу на негормональні причини, та, при необхідності, вжити діагностичних заходів для виключення органічного захворювання чи вагітності. Ці заходи можуть включати вискоблювання. У деяких жінок менструація може не виникнути у період, вільний від застосування пластиру. Якщо лікарський засіб Евра® застосовували відповідно до рекомендацій розділу «Спосіб застосування та дози», малоймовірно, що жінка вагітна. Вагітність не можна виключити, якщо пластир Евра® застосовували не у відповідності до інструкції перед першою або другою пропущеними менструаціями.
У деяких жінок може бути аменорея або олігоменорея після переривання гормональної контрацепції, особливо при наявності цих станів у анамнезі.
Застосування у перiод вагiтностi або годування груддю.
Вагітність
Пластир Евра® не показаний для застосування у період вагітності.
Епiдемiологiчнi дослiдження продемонстрували вiдсутнiсть збільшеного ризику вроджених дефектiв у дiтей, народжених жiнками, якi застосовували гормональнi контрацептиви перед вагiтнiстю. Бiльшiсть нещодавнiх дослiджень також не показали тератогенних ефектів при ненавмисному застосуванні пероральних гормональних контрацептивiв на початку вагітності.
Обмежені дані щодо застосування препарату Евра® вагітним жінкам не дають можливості зробити висновок щодо безпеки цього засобу протягом вагітності.
У ході досліджень на тваринах були випадки побічних реакцій у період вагітності або годування груддю. Тому не слід виключати ризик виникнення побічних реакцій внаслідок гормонального порушення при застосуванні лікарського засобу Евра®, хоча загальний досвід застосування комбінованих пероральних контрацептивів у період вагітності не показав жодних ознак небажаних ефектів у людини.
Якщо вагітність виникла протягом застосування пластиру Евра®, його застосування слід негайно припинити.
Слід враховувати підвищений ризик розвитку ВТЕ у післяпологовому періоді при прийнятті рішення щодо відновлення застосування пластиру Евра® (див. розділ «Спосіб застосування та дози», «Особливості застосування»).
Годування груддю
Також застосування комбінованих гормональних контрацептивів у післяпологовому періоді може негативно вплинути на кількість та якість грудного молока. Матерям, які годують груддю, не слід застосовувати пластир (ТТС) Евра® до завершення періоду годування груддю.
Фертильність
Після припинення застосування препарату Евра® може спостерігатися затримка запліднення.
Здатнicть впливати на швидкiсть реакції при керуванні автотранспортом або iншими механiзмами.
Пластир (ТТС) Евра® не впливає або незначно впливає на швидкicть реакції при керуванні автотранспортом або роботі з іншими механізмами.
Спосіб застосування та дози.
Дози.
Для досягнення максимального контрацептивного ефекту жінка повинна застосовувати пластир (ТТС) Евра®, суворо дотримуючись інструкцій, що наведені нижче у розділі «Як розпочати застосування пластиру (ТТС) Евра®».
Одночасно можна використовувати лише 1 пластир (ТТС) Евра®.
Кожен використаний пластир (ТТС) Евра® знімати та одразу замінювати новим в один і той же день тижня – «день заміни» – на 8-й і 15-й дні менструального циклу. Заміну використаного пластиру можна проводити у будь-який час «дня заміни». Протягом 4-го тижня, з 22-го дня циклу, пластир (ТТС) Евра® не застосовувати.
Новий контрацептивний цикл розпочинається з наступного дня після закінчення 4-го тижня; наступний пластир (ТТС) Евра® слід наклеювати, навіть якщо кровотечі відміни не було або вона не закінчилася.
Hi за яких обставин перерва у використанні пластиру (ТТС) Евра® не повинна перевищувати 7 днiв. Якщо відбулася перерва довше 7 днів, жінка може бути не захищена вiд настання вагітності. У таких випадках протягом 7 днiв необхiдно додатково використовувати бар’єрний метод контрацепції, оскiльки ризик овуляцiї зростає з кожним днем збiльшення рекомендованої тривалостi перiоду, вiльного вiд застосування пластиру (ТТС) Евра®. У разi статевих зносин пiд час такого перiоду слід враховувати імовiрнicть зачаття.
Особливі категорії пацієнтів
Маса тіла 90 кг або більше: у жінок з масою тіла 90 кг і більше ефективність контрацепції може бути знижена.
Ниркова недостатнiсть: застосування лікарського засобу Евра® жiнкам із нирковою недостатністю не вивчалося. Потреби знижувати дозу немає, проте данi свiдчать про більш високий рівень незв’язаної фракцiї етинiлестрадiолу, тому препарат Евра® цiй категорії пацiєнтiв слiд застосовувати пiд контролем.
Печiнкова недостатнiсть: застосування препарату Евра® жiнкам із печінковою недостатністю не вивчалося. Евра® протипоказана жiнкам із печiнковою недостатнiстю (див. розділ «Протипоказання»).
Пацієнти літнього віку: Евра® не призначена для застосування в якості гормональної замісної терапiї жiнкам у перiод постменопаузи.
Діти: безпека та ефективність пластиру (ТТС) Евра® встановлена для жінок віком від 18 років. Не рекомендується застосовувати Евра® до настання першої менструації.
Спосіб застосування.
Пластир (ТТС) Евра® слід наклеювати на чисту, суху, інтактну i здорову шкіру сідниць, живота, зовнішню поверхню верхньої частини плеча або верхньої частини тулуба без оволосiння, на ділянках, де вона не буде контактувати з одягом, який щільно прилягає до тіла. Пластир (ТТС) Евра® не можна приклеювати на груди або ділянки шкіри з почервонінням, подразненням або порізами. Щоб уникнути можливого подразнення, кожен наступний пластир (ТТС) Евра® необхідно наклеювати на іншу ділянку шкіри, це можна робити у межах однієї i тієї самої анатомічної ділянки.
Пластир (ТТС) Евра® необхідно щільно притиснути, щоб його краї добре прилягали до шкіри.
Для запобігання зниженню адгезивних властивостей пластиру (ТТС) Евра® не можна наносити макіяж, креми, лосьйони, пудри та інші локальні засоби на ті ділянки шкіри, де він приклеєний або буде приклеєним.
Жінка повинна щоденно оглядати трансдермальний пластир для того, щоб бути впевненою в його щільному приклеюванні.
Пластир (ТТС) Евра® не можна розрізати, пошкоджувати або змінювати будь-яким чином, оскільки це може поставити під загрозу ефективність контрацепції.
Використаний трансдермальний пластир необхідно утилізувати відповідно до інструкцій, наведених у розділі «Особливі заходи безпеки».
Як розпочати застосування пластиру (ТТС) Евра®?
Якщо під час попереднього менструального циклу жінка не застосовувала гормональний контрацептив
Контрацепцію за допомогою пластиру (ТТС) Евра® розпочинати у 1-й день менструації. Приклеювати до шкіри 1 пластир (ТТС) Евра® i носити його весь тиждень (7 днів). День приклеювання першого пластиру (ТТС) Евра® (l-й день/день початку) визначає наступні дні заміни. День заміни буде приходитися на цей самий день кожного тижня (8-й, 15-й, 22-й дні циклу та 1-й день наступного циклу). На 22-й день циклу пластир Евра® знiмати, i протягом четвертого тижня циклу жiнка не застосовує пластир (ТТС) Евра®.
Якщо жiнка розпочинає застосування трансдермального пластиру (ТТС) Евра® не з першого дня циклу, то слiд одночасно використовувати бар’єрні методи контрацепцiї протягом 7 перших днiв першого контрацептивного циклу.
Якщо жiнка переходить із застосування комбiнованого перорального контрацептиву на використання пластиру (ТТС) Евра®
Пластир (ТТС) Евра® слiд наклеювати на шкiру у 1-й день менструації, що розпочинається пiсля припинення прийому комбiнованого перорального контрацептиву. Якщо протягом 5 днiв пiсля прийому контрацептивної таблетки менструацiя не розпочинається, перед початком застосування пластиру (ТТС) Евра® необхiдно виключити вагітність. Якщо застосування Евра® розпочати пізніше першого дня менструацiї, то протягом 7 днів необхідно одночасно використовувати бар’єрні методи контрацепцiї.
Якщо пiсля прийому останньої контрацептивної таблетки пройшло більше 7 днів, то у жiнки може виникнути овуляцiя, i тому вона повинна проконсультуватися з лiкарем перед тим, як розпочати застосування пластиру (ТТС) Евра®. Статеві зносини під час цього збільшеного періоду, вільного вiд прийому контрацептивних таблеток, можуть призвести до настання вагітності.
Якщо жінка переходить із застосування препаратів, що містять лише прогестаген, на застосування пластиру (ТТС) Евра®
Жінка може у будь-який день перейти із застосування препарату, що містить лише прогестаген (у день видалення імплантату, в день, коли потрібно зробити чергову ін’єкцію), на застосування пластиру (ТТС) Евра®, але протягом перших 7 днів застосування пластиру (ТТС) Евра® слід використовувати бар’єрний метод для посилення контрацептивного ефекту.
Після аборту або викидня
Після аборту або викидня до 20-го тижня вагітності можна одразу розпочинати застосування пластиру (ТТС) Евра®. Якщо жінка починає використовувати пластир (ТТС) Евра® одразу після аборту або викидня, застосовувати додатковий метод контрацепції не обов’язково. Жінка повинна знати, що овуляція може відбутися протягом 10 днів після аборту або викидня.
Після аборту або викидня на 20-му тижні вагітності і пізніше застосування пластиру (ТТС) Евра® можна розпочинати на 21-й день після аборту або викидня або у перший день першої менструації. Частота виникнення овуляції на 21-й день після аборту (на 20-му тижні вагітності) невідома.
Після пологів
Жінки, які не годують дитину груддю, можуть розпочинати застосування пластиру (ТТС) Евра® не раніше ніж через 4 тижні після пологів. Якщо жінка починає застосовувати пластир (ТТС) Евра® пізніше, то протягом перших 7 днів слід додатково використовувати бар’єрний метод контрацепції. Якщо були статеві зносини, то необхідно виключити імовірність вагітності перед тим, як розпочинати застосування пластиру (ТТС) Евра®, або жінка повинна дочекатися першої менструації.
Щодо застосування пластиру жінкам, що годують груддю, див. розділ «Застосування у перiод вагiтностi або годування груддю».
При повному або частковому вiдклеюваннi пластиру (ТТС) Евра®
Якщо пластир (ТТС) Евра® повнiстю або частково вiдклеївся, то у кров надходить недостатня кiлькiсть його активних компонентiв.
Навіть при частковому вiдклеюваннi пластиру (ТТС) Евра®:
- менш нiж протягом доби (24 години) слiд знову приклеїти пластир (ТТС) Евра® на ту саму дiлянку тiла або одразу ж замiнити його новим трансдермальним пластирем (ТТС) Евра®. Додатковi контрацептиви не потрiбнi. Наступний пластир Евра® необхiдно приклеїти у звичайний «день замiни»;
- бiльш нiж протягом доби (24 години), а також якщо жiнка не знає точно, коли пластир (ТТС) Евра® частково або повнiстю вiдклеївся: можливе настання вагітності. Жiнка повинна одразу ж почати новий цикл, наклеївши новий пластир (ТТС) Евра®, i вважати цей день першим днем контрацептивного циклу. Бар’єрні методи контрацепції слiд одночасно застосовувати лише у першi 7 днiв нового циклу.
Не слiд намагатися приклеїти пластир (ТТС) Евра®, якщо він втратив свої адгезивнi властивості; замicть цього необхiдно одразу приклеїти новий пластир (ТТС) Евра®. Не можна застосовувати додатковi липкi стрiчки або пов’язки для утримання на місці пластиру (ТТС) Евра®.
Якщо пропущенi черговi днi замiни пластиру (ТТС) Евра®
• На початку будь-якого контрацептивного циклу (l-й тиждень/l-й день): жiнка може бути не захищена вiд вагітності: вона повинна приклеїти перший пластир (ТТС) Евра® нового циклу одразу ж, як тiльки згадає про це. Цей день вважається новим «l-м днем» i вiд нього вiдраховується новий «день замiни». Протягом перших 7 днiв нового циклу слiд одночасно застосовувати негормональну контрацепцiю. У разi статевих зносин пiд час такого подовженого перiоду без застосування пластиру (ТТС) Евра® може вiдбутися заплiднення.
• У серединi циклу (2-й тиждень/8-й день або 3-й тиждень/15-й день):
- якщо вiд дня замiни пластиру пройшла 1 або 2 доби (до 48 годин), жiнка повинна одразу наклеїти новий пластир (ТТС) Евра®. Наступний пластир (ТТС) Евра® необхiдно приклеїти у звичайний «день замiни». Якщо протягом 7 днів, що передують першому пропущеному дню наклеювання пластиру (ТТС) Евра®, жінка правильно використовувала пластир, то додаткова контрацепція не потрібна;
- якщо вiд дня замiни пластиру пройшло бiльше 2 дiб (48 годин i бiльше), жiнка може бути не захищена вiд настання вагітності. Вона повинна припинити поточний контрацептивний цикл i одразу ж розпочати новий 4-тижневий цикл, наклеївши новий пластир (ТТС) Евра®. Цей день вважається новим «l-м днем» i відраховується вiд нього «день замiни». Бар’єрну контрацепцію слiд одночасно застосовувати протягом 7 перших днiв нового циклу.
• Наприкiнцi циклу (4-й тиждень/22-й день): якщо трансдермальний пластир (ТТС) Евра® не знято у кiнцi 4-го тижня (22-й день), його необхiдно зняти якнайшвидше. Черговий цикл контрацепції потрібно розпочинати у звичайний «день замiни», який є наступним днем пiсля 28-го дня. Додаткова контрацепцiя не потрiбна.
Зміна «дня заміни»
Щоб відкласти менструацію на один цикл, жінка повинна приклеїти новий пластир Евра® на початку 4-го тижня (22-й день), пропустивши тим самим період, вільний від застосування пластиру Евра®. Можуть виникнути міжменструальні кровотечі або мажучі виділення. Після 6 тижнів поспіль застосування пластиру (ТТС) Евра® необхідно зробити 7-денний інтервал, вільний від застосування пластиру (ТТС) Евра®. Після закінчення цього інтервалу відновити регулярне застосування препарату.
Якщо жiнка хоче змiнити день замiни пластиру, вона повинна закiнчити поточний цикл, зняти третiй пластир (ТТС) Евра® у призначений для цього день. Протягом тижня, вiльного вiд застосування пластиру (ТТС) Евра®, жiнка може вибрати новий день замiни, наклеївши перший пластир (ТТС) Евра® наступного циклу в обраний день. Перiод, вiльний вiд застосування пластиру (ТТС) Евра®, нi в якому разi не повинен перевищувати 7 днiв. Чим коротший цей період, тим вища імовірність того, що у жінки не буде наступної менструації, а під час наступного контрацептивного циклу можуть виникати міжменструальні кровотечі або мажучі виділення.
При незначному подразненнi шкiри
Якщо застосування пластиру (ТТС) Евра® спричиняє подразнення шкiри, можна приклеїти новий пластир Евра® на iншу дiлянку шкiри i носити його до наступного «дня замiни». Одночасно можна застосовувати лише 1 пластир Евра®.
Діти.
Пластир (ТТС) Евра® не рекомендується застосовувати дітям (до 18 років) через недостатність даних щодо безпеки та ефективності застосування. Не рекомендується застосовувати лікарський засіб Евра® до настання першої менструації.
Передозування.
При випадковому застосуванні більших доз пероральних контрацептивів не повідомлялося про серйозні побічні реакції. Передозування може спричиняти нудоту або блювання. У деяких жінок можуть виникати піхвові кровотечі. При пiдозрi на передозування необхідно зняти пластир (ТТС) Евра® та провести симптоматичну терапію.
Побічні реакції.
Найчастішими побічними реакціями, що спостерігалися під час клінічних досліджень, були головний біль, нудота та чутливість молочних залоз, які розвивалися приблизно у 21 %, 16,6 % та 15,9 % випадків відповідно. Побічні реакції, що можуть з’являтися на початку лікування, але зазвичай зникають після перших трьох циклів, включають мажучі виділення, нагрубання молочних залоз та нудоту.
У жінок, які застосовують КГК, спостерігається підвищений ризик артеріальних та венозних тромботичних та тромбоемболічних порушень, включаючи інфаркт міокарда, інсульт, транзиторні ішемічні атаки, тромбоз вен та емболію легень (див. розділ «Особливості застосування»).
Безпека пластиру (ТТС) Евра® оцінювалася з участю 3322 жінок, які вели активне статеве життя та брали участь у клінічних дослідженнях ІІІ фази, що проводилися з метою оцінки контрацептивної ефективності. Ці жінки застосовували контрацепцію впродовж 6 або 13 циклів (пластир (ТТС) Евра® або пероральний контрацептив для порівняння), прийняли хоча б одну дозу досліджуваного препарату та надали інформацію щодо побічних реакцій. У нижченаведеній таблиці 3 зазначені побічні реакції, що спостерігалися під час клінічних досліджень та у постмаркетинговому періоді. Частота побічних реакцій оцінена як: дуже часто (≥1/10); часто (≥1/100 до <1/10); нечасто (≥ 1/1000 до <1/100); рідко (≥ 1/10000 до <1/1000); дуже рідко (<1/10000), невідомо (частота не може бути встановлена з доступних даних).
Таблиця 4
Частота побічних реакцій
|
Системи органів/частота |
||||
|
Дуже часто |
Часто |
Нечасто |
Рідко |
Невідомо |
|
Інфекції та інвазії |
||||
|
(Вульво)вагінальні грибкові інфекції, вагінальний кандидоз |
Пустульозні висипи*, пустули у місці застосування |
|||
|
Доброякісні новоутворення, злоякісні та невстановлені (включаючи кісти та поліпи) |
||||
|
Печінкові новоутворення*†, рак молочної залози*†, рак шийки матки*†, печінкова аденома*†, маткова лейоміома, фіброаденома молочної залози |
||||
|
З боку імунної системи |
||||
|
Реакції гіперчутливості |
Анафілактичні реакції* |
Загострення симптомів спадкового та набутого ангіоневротичного набряку* |
||
|
Метаболічні порушення |
||||
|
Гіперхолестеринемія, затримка рідини, підвищення апетиту |
Гіперглікемія*, резистентність до інсуліну* |
|||
|
Психічні розлади |
||||
|
Зміни настрою, лабільність емоційних реакцій, занепокоєння |
Безсоння, зниження лібідо |
Агресія*, засмученість*, підвищення лібідо |
||
|
З боку центральної та периферичної нервової системи |
||||
|
Головний біль |
Мігрень, запаморочення |
Гострі порушення мозкового кровообігу**†, мозкова кровотеча*†, спотворення смаку* |
||
|
З боку органів зору |
||||
|
Непереносимість контактних лінз* |
||||
|
З боку серця |
||||
|
Артеріальна тромбоемболія, (гострий) інфаркт міокарда*† |
||||
|
З боку судинної системи |
||||
|
Артеріальна гіпертензія |
Гіпертензивний криз*, артеріальний тромбоз**†, венозний тромбоз**†, тромбоз*†, венозна тромбоемболія |
|||
|
З боку дихальної системи |
||||
|
Легеневий (артеріальний) тромбоз*†, легенева емболія† |
||||
|
З боку травної системи |
||||
|
Нудота |
Біль у животі, блювання, діарея, здуття живота |
Коліт* |
||
|
З боку гепатобіліарної системи |
||||
|
Холецистит, холелітіаз†, ураження печінки*, холестатична жовтяниця*†, холестаз*† |
||||
|
З боку шкіри та підшкірної тканини |
||||
|
Акне, висипання, свербіж, шкірні реакції, подразнення шкіри |
Алопеція, алергічний дерматит, екзема, реакції фоточутливості, контактний дерматит, кропив’янка, еритема |
Ангіоневротичний набряк*, еритема (мультиформна, вузликова)*, хлоазма†, ексфоліативні висипання*, генералізований свербіж, висипання (еритематозні, свербіжні), себорейний дерматит* |
||
|
З боку кістково-м’язової системи |
||||
|
Спазми м’язів |
||||
|
З боку репродуктивної системи |
||||
|
Нагрубання молочних залоз |
Дисменорея, маткові кровотечі та менструальні розлади**†, спазм матки, дискомфорт у грудях, вагінальні розлади |
Галакторея, передменструальний синдром, вульвовагінальна сухість |
Дисплазія шийки матки*, погіршення лактації, генітальні виділення |
|
|
Загальні розлади та реакції у місці введення |
||||
|
Нездужання, підвищена втомлюваність, реакції у місці застосування (еритема, подразнення, свербіж, висипання) |
Генералізований набряк, периферичний набряк, реакції у місці застосування** |
Набряк обличчя*, точковий набряк*, набряки, реакції у місці застосування* (абсцес, ерозія), локалізований набряк* |
||
|
Результати лабораторних досліджень |
||||
|
Збільшення маси тіла |
Підвищення артеріального тиску, порушення рівня тригліцеридів крові** |
Зниження рівня глюкози крові*†, порушення рівня глюкози крові*† |
||
*Побічні реакції, виявлені у післяреєстраційний період.
**Включаючи побічні реакції, виявлені у ході клінічних досліджень та післяреєстраційного періоду.
†Див. розділ «Особливості застосування».
Повідомлення про підозрювані побічні реакції
Повідомлення про побічні реакції після реєстрації лікарського засобу має важливе значення. Це дає змогу проводити моніторинг співвідношення користь/ризик при застосуванні цього лікарського засобу. Медичним та фармацевтичним працівникам, а також пацієнтам або їхнім законним представникам слід повідомляти про усі випадки підозрюваних побічних реакцій та відсутності ефективності лікарського засобу через Автоматизовану інформаційну систему з фармаконагляду за посиланням: https://aisf.dec.gov.ua.
Термін придатності. 2 роки.
Умови зберігання.
Зберігати в оригінальній упаковці при температурі не вище 30 °С у недоступному для дітей місці. Не зберігати у холодильнику або морозильній камері.
Упаковка.
По 1 пластиру в пакеті із ламінованого паперу і алюмінієвої фольги; по 3 пакети в прозорому пакетику з полімерної плівки; по 1 або 3 прозорі пакетики (3 або 9 пластирів) разом зі спеціальними наклейками на календар для позначок про використання пластиру (ТТС) у картонній упаковці.
Категорія відпуску.
За рецептом.
Виробник.
Виробництво нерозфасованого продукту та первинна упаковка:
ЛТС Ломанн Терапевтичні Системи АГ/ LTS Lohmann Therapie – Systeme AG.
Вторинна упаковка та випуск серій:
ВАТ «Гедеон Ріхтер»/Gedeon Richter Plc.
Місцезнаходження виробника та його адреса місця провадження діяльності.
Ломаннштрассе, 2, Д-56626, Андернах, Німеччина/ Lohmannstrasse 2, D-56626 Andernach, Germany.
Н-1103, Будапешт, вул. Демреї, 19-21, Угорщина/ Н-1103, Budapest, Gyomroi ut., 19-21, Hungary.