Вазар
- Список товаров
- Цены в аптеках
- Аналоги
Товаров: 2
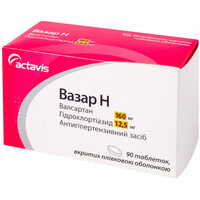
Актавис/Балканфарма-Дупниця (Болгария)
от 230.50 ₴
По рецепту
в 10 аптеках
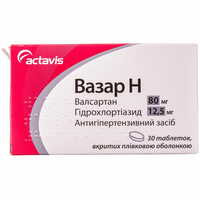
Актавис/Балканфарма-Дупниця (Болгария)
от 162.00 ₴
По рецепту
в 7 аптеках
Инструкция для Вазар Н таблетки по 160 мг / 12,5 мг №30 (3 блистера х 10 таблеток)
Инструкция указана для «Вазар Н таблетки по 160 мг / 12,5 мг №30 (3 блистера х 10 таблеток)»
Цена на Вазар начинается от 162.00
| Название | Цена ₴ |
|---|---|
| Вазар Н таблетки по 80 мг / 12,5 мг №30 (3 блистера х 10 таблеток) | 162.00 ₴ |
| Вазар Н таблетки по 160 мг / 12,5 мг №30 (3 блистера х 10 таблеток) | 230.50 ₴ |
Аналоги

от 236.40 ₴
в 320 аптеках

Польфарма (Польша)
от 350.00 ₴
в 182 аптеках

от 242.00 ₴
в 24 аптеках

от 814.40 ₴
в 279 аптеках

от 244.55 ₴
в 74 аптеках

Актавис/Балканфарма-Дупниця (Болгария)
от 205.10 ₴
в 189 аптеках

от 630.27 ₴
в 122 аптеках

Актавис/Балканфарма-Дупниця (Болгария)
от 140.70 ₴
в 160 аптеках

от 775.95 ₴
в 210 аптеках

от 636.53 ₴
в 251 аптеке

от 200.60 ₴
в 233 аптеках

от 289.10 ₴
в 310 аптеках

от 79.80 ₴
в 5 аптеках

Маклеодс Фармасьютикалс (Индия)
от 204.10 ₴
в 73 аптеках

от 88.60 ₴
в 8 аптеках

от 348.50 ₴
в 1 аптеке

Польфарма (Польша)
от 239.40 ₴
в 179 аптеках

от 451.00 ₴
в 86 аптеках
от 496.49 ₴
в 48 аптеках

от 317.26 ₴
в 85 аптеках

Маклеодс Фармасьютикалс (Индия)
от 224.70 ₴
в 4 аптеках
от 428.20 ₴
в 2 аптеках

от 201.70 ₴
в 59 аптеках

от 208.80 ₴
в 32 аптеках

от 182.54 ₴
в 61 аптеке

Нет в Одессе
от 279.00 ₴
в 1 аптеке

от 411.74 ₴
в 42 аптеках

от 215.33 ₴
в 123 аптеках

от 116.06 ₴
в 75 аптеках

от 167.99 ₴
в 176 аптеках

от 831.10 ₴
в 96 аптеках
Актавис/Балканфарма-Дупниця (Болгария)
от 162.00 ₴
в 7 аптеках

Маклеодс Фармасьютикалс (Индия)
от 177.10 ₴
в 68 аптеках

от 235.20 ₴
в 9 аптеках

от 459.60 ₴
в 36 аптеках
Также ищут
Искать в других городах
Белгород-Днестровский
Беляевка
Вилково
Винница
Врадиевка
Днепр
Житомир
Запорожье
Киев
Коблево
Кременчуг
Кривой Рог
Кропивницкий
Крыжановка
Львов
Николаев
Полтава
Раздельная
Сумы
Харьков
Херсон
Хлебодарское
Черкассы
Чернигов
Черноморск
Южноукраинск
Другие изображения Вазар

Просмотренные товары



Выберите товар
Выберите товар





