Кабометикс
- Список товарів
- Ціни в аптеках
Інструкція вказана для «Кабометикс таблетки по 60 мг №30 (пляшка)»
Склад:
діюча речовина: кабозантініб (S)-малат
1 таблетка, вкрита плівковою оболонкою, містить кабозантінібу (S)-малату, що еквівалентно кабозантінібу 20 мг або 40 мг, або 60 мг;
допоміжні речовини: целюлоза мікрокристалічна, лактоза безводна, гідроксипропілцелюлоза, натрію кроскармелоза, кремнію діоксид колоїдний (безводний), магнію стеарат;
плівкова оболонка: опадрай жовтий (03K92254): гіпромелоза (HPMC) 2910 (Е 464), титану діоксид (Е 171), триацетин, заліза оксид жовтий (Е 172).
Лікарська форма.
Таблетки, вкриті плівковою оболонкою.
Основні фізико-хімічні властивості.
КАБОМЕТИКС, таблетки, вкриті плівковою оболонкою, по 20 мг
Круглі таблетки, вкриті плівковою оболонкою, жовтого кольору, з тисненням «XL» на одному боці та «20» на іншому боці таблетки.
КАБОМЕТИКС, таблетки, вкриті плівковою оболонкою, по 40 мг
Трикутні таблетки, вкриті плівковою оболонкою, жовтого кольору, з тисненням «XL» на одному боці та «40» на іншому боці таблетки.
КАБОМЕТИКС, таблетки, вкриті плівковою оболонкою, по 60 мг
Овальні таблетки, вкриті плівковою оболонкою, жовтого кольору, з тисненням «XL» на одному боці та «60» на іншому боці таблетки.
Фармакотерапевтична група.
Антинеопластичні лікарські засоби. Інгібітори протеїнкінази. Кабозантініб.
Код АТХ L01E X07.
Фармакологічні властивості.
Фармакодинаміка.
Механізм дії
Кабозантініб – низькомолекулярний інгібітор тирозинкінази, що інгібує множинні рецепторні тирозинкінази (RTKs), які беруть участь у процесах росту пухлин та ангіогенезу, патологічної зміни кісткової тканини, стійкості до лікарських засобів та метастатичної прогресії пухлини. У результаті оцінки інгібуючої активності проти різних кіназ кабозантініб був визначений інгібітором рецепторів МЕТ (рецептор фактора росту гепатоцитів) та рецепторів VEGF (фактор росту ендотелію судин). Крім того, кабозантініб інгібує інші тирозинкінази, включаючи GAS6-рецептор (AXL), RET, ROS1, TYRO3, MER, рецептор фактора стовбурових клітин (КІТ), TRKB, Fms-подібну тирозинкіназу-3 (FLT3) та ТІЕ-2.
Фармакодинамічні ефекти
Кабозантініб показав пригнічення росту пухлини, пов’язане з дозою, регрес пухлини та/або пригнічене метастазування в широкому діапазоні доклінічних моделей пухлини.
Кардіологічна електрофізіологія
Збільшення від вихідного рівня у корегованому інтервалі QT з коригуванням Фрідеріція (QTcF) на 10–15 мсек на 29-й день (але не на 1-й день) після початку лікування кабозантінібом (в дозі 140 мг на день) спостерігалося у контрольованому клінічному дослідженні за участю хворих на медулярний рак щитовидної залози. Цей ефект не був пов’язаний із морфологічними змінами передсердної хвилі або виникненням нових серцевих ритмів. У цьому дослідженні жоден пацієнт, який отримував кабозантініб, не мав підтвердженого QTcF > 500 мсек, що не було підтверджено при лікуванні НКК або ГЦК (у дозі 60 мг).
Клінічна ефективність та безпека
Клінічні дані щодо нирковоклітинної карциноми (НКК) після попереднього лікування засобами, які впливають на фактор росту ендотелію судин (VEGF)
Безпеку та ефективність застосування лікарського засобу КАБОМЕТИКС при лікуванні нирковоклітинної карциноми після попереднього лікування засобами, які впливають на VEGF, оцінювали у рандомізованому відкритому багатоцентровому дослідженні ІІІ фази (METEOR). Пацієнти з розповсюдженою світлоклітинною нирковоклітинною карциномою (НКК), які раніше отримували щонайменше 1 курс лікування інгібіторами рецепторів тирозинкінази VEGF (VEGFR TKI), були рандомізовані (1:1) для прийому КАБОМЕТИКСУ (N = 330) або еверолімусу (N = 328). Пацієнти могли отримувати інші попередні курси терапії, включаючи цитокіни, або антитіла, спрямовані на VEGF, на рецептори запрограмованої клітинної смерті-1 (PD-1) або його ліганди. Допускалися раніше ліковані пацієнти із метастазами у головний мозок. Виживаність без прогресування захворювання оцінювалася комітетом з проведення сліпої незалежної радіологічної експертизи, а первинний аналіз був проведений серед перших 375 рандомізованих пацієнтів. Вторинними кінцевими точками були частка пацієнтів з об’єктивною відповіддю та загальна виживаність (ЗВ). Оцінювання пухлини проводилися кожні 8 тижнів протягом перших 12 місяців, потім – через кожні 12 тижнів.
Базові демографічні показники та характеристики захворювання були подібними у групах, що приймали КАБОМЕТИКС та еверолімус. Більшість пацієнтів були чоловічої статі (75 %), середній вік – 62 роки. 71 % пацієнтів отримали лише один попередній курс VEGFR TKI; 41 % пацієнтів отримали сунітиніб як єдиний попередній курс VEGFR TKI. Відповідно до критеріїв прогностичної категорії ризику Меморіального онкологічного центру Слоана–Кеттерінга (MSKCC), 46 % мали сприятливий перебіг (0 факторів ризику), 42 % – проміжний (1 фактор ризику), 13 % – поганий (2 або 3 фактори ризику). 54 % пацієнтів мали 3 або більше органів з метастазами, включаючи легені (63 %), лімфатичні вузли (62 %), печінку (29 %) та кістки (22 %). Середня тривалість лікування становила 7,6 місяця (діапазон 0,3–20,5) у пацієнтів, які отримували КАБОМЕТИКС, та 4,4 місяця (діапазон 0,21–18,9) у пацієнтів, які отримували еверолімус.
Статистично значуще покращення виживаності без прогресування захворювання спостерігається при застосуванні КАБОМЕТИКСУ у порівнянні з еверолімусом (рисунок 1 та таблиця 1). Планований проміжний аналіз загальної виживаності проводився під час аналізу виживаності без прогресування захворювання та не досяг межі статистичної значущості (202 явища, НR = 0,68 [0,51, 0,90], р = 0,006). У наступному незапланованому проміжному аналізі загальної виживаності було показано статистично значуще покращення у хворих, які приймали КАБОМЕТИКС, порівняно з групою еверолімусу (320 явищ, медіана 21,4 місяця та 16,5 місяця, НR = 0,66 [0,53, 0,83], р = 0,0003, рисунок 2). Порівнянні результати щодо ЗВ спостерігалися при подальшому (дескриптивному) аналізі 430 явищ.
Дослідницький аналіз виживаності без прогресування захворювання та загальної виживаності у групі «всі рандомізовані пацієнти, які отримали не менше однієї дози досліджуваного лікарського засобу» також показав надійні результати на користь КАБОМЕТИКСУ у порівнянні з еверолімусом у різних підгрупах відповідно до віку (до < 65 років у порівнянні з > 65 років, стать, група ризику Меморіального онкологічного центру Слоана – Кеттерінга (сприятливий, проміжний, поганий), ECOG статус (0 або 1), час від постановки діагнозу до рандомізації (до < 1 року порівняно з > 1 року), МЕТ статус пухлини (високий в порівнянні з низьким або невідомим), метастази в кістках (відсутність в порівнянні з наявністю), вісцеральні метастази (відсутність в порівнянні з присутністю), метастази в кістках та вісцеральні метастази (відсутність в порівнянні з наявністю), кількість попередніх курсів VEGFR-TKI (1 порівняно з > 2), тривалість першого VEGF(< 6 місяців порівняно > 6 місяців). Результати щодо частки пацієнтів з об’єктивною відповіддю наведено у таблиці 2.
|
Кількість пацієнтів групи ризику КАБОМЕТИКС Еверолімус |
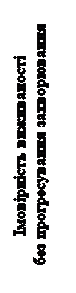
|
КАБОМЕТИКС Еверолімус |
|
Місяці |
Рис. 1. Крива виживаності без прогресування захворювання, визначеної незалежним комітетом радіологічної експертизи у пацієнтів з НКК після попереднього лікування засобами, які впливають на фактор росту ендотелію судин (VEGF) (перші 375 рандомізованих пацієнтів) (метод Каплана – Мейєра, дослідження METEOR)
Таблиця 1
Резюме результатів виживаності без прогресування захворювання (ВБПЗ), визначеної незалежним комітетом радіологічної експертизи у пацієнтів з НКК після попереднього лікування засобами, які впливають на фактор росту ендотелію судин (VEGF) (дослідження METEOR)
|
Первинний аналіз ВБПЗ популяції |
Популяція ІТТ |
|||
|
Кінцева точка |
КАБОМЕТИКС |
Еверолімус |
КАБОМЕТИКС |
Еверолімус |
|
N = 187 |
N = 188 |
N = 330 |
N = 328 |
|
|
Медіана часу ВБПЗ (95 % ДІ – довірчий інтервал), місяці |
7,4 (5,6; 9,1) |
3,8 (3,7; 5,4) |
7,4 (6,6; 9,1) |
3,9 (3,7; 5,1) |
|
Співвідношення ризиків(HR) (95 % ДІ), p-значення1 |
0,58 (0,45; 0,74), p < 0,0001 |
0,51 (0,41; 0,62), p < 0,0001 |
||
1 Стратифікований логарифмічний ранговий критерій.
|
Кількість пацієнтів групи ризику КАБОМЕТИКС Еверолімус |
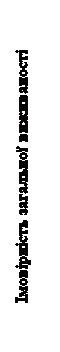
|
КАБОМЕТИКС Еверолімус |
|
Місяці |
Рис. 2. Крива загальної виживаності пацієнтів з НКК після попереднього лікування засобами, які впливають на фактор росту ендотелію судин (VEGF) (метод Каплана –Мейєра, дослідження METEOR)
Таблиця 2
Резюме даних стосовно кількості пацієнтів з об’єктивною відповіддю згідно зі звітом незалежного комітету радіологічної експертизи (IRC) та звіту дослідників серед хворих на НКК після попереднього лікування засобами, які впливають на фактор росту ендотелію судин (VEGF)
|
Кінцева точка |
Первинний аналіз показника об’єктивної відповіді в популяції ІТТ, дані IRC |
Показник об’єктивної відповіді в популяції ІТТ, дані дослідників |
||
|
КАБОМЕТИКС |
Еверолімус |
КАБОМЕТИКС |
Еверолімус |
|
|
N = 330 |
N = 328 |
N = 330 |
N = 328 |
|
|
Показник об’єктивної відповіді (лише часткова об’єктивна відповідь) (ДІ 95 %) |
17 % (13 %, 22 %) |
3 % (2 %, 6 %) |
24 % (19 %, 29 %) |
4 % (2 %, 7 %) |
|
p-значення1 |
p < 0,0001 |
p < 0,0001 |
||
|
Часткова відповідь |
17 % |
3 % |
24 % |
4 % |
|
Медіана часу до першої відповіді, місяці (ДІ 95%) |
1,91 (1,6; 11,0) |
2,14(1,9; 9,2) |
1,91 (1,3; 9,8) |
3,50 (1,8;5,6) |
|
Стабілізація захворювання як найкраща відповідь |
65 % |
62 % |
63 % |
63 % |
|
Прогресування захворювання як найкраща відповідь |
12 % |
27 % |
9 % |
27 % |
1 Критерій хі-квадрат.
Клінічні дані щодо лікування пацієнтів з нирковоклітинною карциномою, які раніше не отримували лікування
Безпеку та ефективність застосування лікарського засобу КАБОМЕТИКС пацієнтам з нирковоклітинною карциномою, які раніше не отримували лікування, оцінювали в рандомізованому відкритому багатоцентровому дослідженні (CABOSUN). Пацієнти (N = 157) з раніше не лікованою, місцево розповсюдженою або метастатичною світлоклітинною НКК були рандомізовані (1:1) для отримання лікарського засобу КАБОМЕТИКС (N = 79) або сунітинібу (N = 78). Пацієнти повинні були мати захворювання середнього або високого ризику відповідно до визначень категорій ризику за класифікацією Міжнародного консорціуму баз даних метастатичних форм НКК (IMDC). Пацієнти були стратифіковані за групою ризику IMDC і наявністю кісткових метастазів (так/ні). Близько 75 % пацієнтів перенесли операцію з видалення нирки до початку лікування.
Пацієнт повинен був мати один або два із зазначених нижче факторів ризику у випадку середнього ризику та три або більше факторів у випадку високого ризику: час з моменту діагностики НКК до системного лікування < 1 року, гемоглобін < НМН (нижня межа норми), корегований рівень кальцію > ВМН (верхня межа норми), індекс KPS < 80 %, нейтрофіли > ВМН, тромбоцити > ВМН.
Первинною кінцевою точкою була виживаність без прогресування захворювання. Вторинні кінцеві точки ефективності були визначені як показник об’єктивної відповіді та загальна виживаність. Оцінку пухлини проводили кожні 12 тижнів.
Вихідні демографічні показники та характеристики захворювання були аналогічними у групах застосування лікарського засобу КАБОМЕТИКС та сунітинібу. Більшість пацієнтів були чоловіками (78 %); середній вік – 62 роки. Розподіл пацієнтів за групами ризику IMDC був таким: 81 % пацієнтів у групі середнього ризику (1–2 фактори ризику), а 19 % – в групі високого ризику (≥ 3 факторів ризику). Більшість пацієнтів (87 %) мали оцінку за функціональним статусом ECOG 0 або 1; 13 % – оцінку 2. Кісткові метастази виявлено у 36 % пацієнтів.
Статистично значуще поліпшення виживаності без прогресування захворювання, яке ретроспективно оцінював незалежний комітет з проведення сліпої радіологічної експертизи (IRC), продемонструвало переваги на користь лікарського засобу КАБОМЕТИКС порівняно з сунітинібом (рисунок 3, таблиця 3). Результати аналізу, проведеного дослідником та IRC, щодо визначення виживаності без прогресування захворювання узгоджувалися між собою.
Пацієнти з позитивним і негативним статусом МЕТ демонстрували сприятливий ефект лікарського засобу КАБОМЕТИКС порівняно з сунітинібом; причому більша активність спостерігалася у пацієнтів з позитивним статусом МЕТ в порівнянні з пацієнтами з негативним статусом MET (HR = 0,32 (0,16, 0,63) порівняно з 0,67 (0,37, 1,23) відповідно).
Терапію лікарським засобом КАБОМЕТИКС пов’язували з тенденцією до більш тривалої виживаності порівняно з сунітинібом (таблиця 3). Це дослідження було недостатньо потужним для аналізу загальної виживаності, а отримані дані були незрілими.
Дані стосовно показника об’єктивної відповіді наведено в таблиці 3.
|
Кількість пацієнтів групи ризику КАБОМЕТИКС Еверолімус |
|
КАБОМЕТИКС Еверолімус |
|
Місяці |
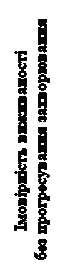
Рис. 3. Крива виживаності без прогресування захворювання у пацієнтів з НКК, які раніше не отримували лікування (дані IRC, метод Каплана – Мейєра)
Таблиця 3
Результати ефективності у пацієнтів з НКК, які раніше не отримували лікування (популяція ITT, дослідження CABOSUN)
|
Показник |
КАБОМЕТИКС (N = 79) |
Сунітиніб (N = 78) |
|
Виживаність без прогресування захворювання за даними IRCа |
||
|
Медіана виживаності без прогресування (95 % ДІ) |
8,6 (6,2; 14,0) |
5,3 (3,0; 8,2) |
|
HR (95 % ДІ); стратифікованоб, в |
0,48 (0,32; 0,73) |
|
|
Двостороннє, логарифмічне рангове p-значення: стратифікованоб |
p = 0,0005 |
|
|
Виживаність без прогресування захворювання за даними дослідника |
||
|
Медіана виживаності без прогресування (95 % ДІ) |
8,3 (6,5; 12,4) |
5,4 (3,4; 8,2) |
|
HR (95 % ДІ), стратифікованоб, в |
0,56 (0,37; 0,83) |
|
|
Двостороннє, логарифмічне рангове p-значення: стратифікованоб |
p = 0,0042 |
|
|
Загальна виживаність |
||
|
Медіана загальної виживаності у місяцях (95 % ДІ) |
30,3 (14,6; NE) |
21,0 (16,3; 27,0) |
|
HR (95 % ДІ), стратифікованоб, в |
0,74 (0,47; 1,14) |
|
|
Показник об’єктивної відповіді, n (%) за даними IRC |
||
|
Повні відповіді |
0 |
0 |
|
Часткові відповіді |
16 (20) |
7 (9) |
|
Об’єктивна відповідь (лише часткові відповіді) |
16 (20) |
7 (9) |
|
Стабілізація захворювання |
43 (54) |
30 (38) |
|
Прогресування захворювання |
14 (18) |
23 (29) |
|
Показник об’єктивної відповіді, n (%) за даними дослідника |
||
|
Повні відповіді |
1 (1) |
0 |
|
Часткові відповіді |
25 (32) |
9 (12) |
|
Об’єктивна відповідь (лише часткові відповіді) |
26 (33) |
9 (12) |
|
Стабілізація захворювання |
34 (43) |
29 (37) |
|
Прогресування захворювання |
14 (18) |
19 (24) |
а Відповідно до прийнятих в ЄС цензурування даних.
б Фактори стратифікації відповідно до IxRS включали категорії ризиків IMDC (середній ризик, високий ризик та наявність метастазів у кістках (так/ні)).
в Розраховано на основі моделі пропорційних ризиків Кокса з корегуванням на фактори стратифікації відповідно до IxRS. Відношення ризиків < 1 вказує на виживаність без прогресування на користь кабозантінібу.
Клінічні дані при гепатоцелюлярній карциномі (ГЦК)
Безпеку та ефективність застосування лікарського засобу КАБОМЕТИКС оцінювали в рандомізованому подвійно сліпому плацебо-контрольованому дослідженні фази ІІІ (CELESTIAL). Пацієнти (N = 707) з ГЦК, що не реагує на радикальне лікування, які раніше отримували сорафеніб у зв’язку з розповсюдженою формою захворювання, були рандомізовані (2:1) для отримання лікарського засобу КАБОМЕТИКС (N = 470) або плацебо (N = 237). Пацієнти могли отримувати ще одну попередню системну терапію у зв’язку з розповсюдженою формою захворювання на додаток до сорафенібу. Рандомізація була стратифікована за етіологією захворювання (вірус гепатиту В [з або без вірусу гепатиту С], вірус гепатиту С [без вірусу гепатиту В] або інша категорія пацієнтів), географічним регіоном (Азія, інші регіони) та за наявністю екстрагепатичного поширення захворювання та/або макроваскулярних інвазій (так/ні).
Первинна кінцева точка ефективності була визначена як загальна виживаність. Вторинними кінцевими точками ефективності були виживаність без прогресування захворювання та показник об’єктивної відповіді, що оцінюються дослідником з використанням Критеріїв оцінки відповіді на лікування при солідних пухлинах (RECIST) 1.1. Пухлини оцінювали кожні 8 тижнів. Суб’єкти продовжували лікування сліпим методом після радіологічного підтвердження прогресування захворювання, допоки вони відчували клінічні переваги або допоки не виникне потреба у подальшій системній терапії або місцевій, спрямованій на печінку протипухлинній терапії. Перехід з плацебо до кабозантінібу не дозволявся під час сліпої фази лікування.
Базові демографічні показники та характеристики захворювання були подібними у групах застосування лікарського засобу КАБОМЕТИКС та плацебо і представлені нижче для всіх 707 рандомізованих пацієнтів:
чоловіки – 82 %;
середній вік пацієнтів – 64 роки;
представники європеоїдної раси – 56 %, азіати – 34 %;
оцінка функціонального статусу за критеріями ECOG на рівні 0 – 53 % або на рівні 1 – 47 %;
печінкова недостатність ступеня А за класифікацією Чайлда – П’ю – 99 %, ступеня В – 1 %;
етіологія ГКК включала 38 % пацієнтів з вірусом гепатиту В (ВГВ), 21 % – з вірусом гепатиту С (ВГС), 40 % – інших (ані ВГВ, ані ВГС);
наявність макроскопічної судинної інвазії та/або позапечінкової пухлини – 78 %;
рівні альфа-фетопротеїну (AFP) ≥ 400 мкг/л – 41 %;
місцево-реґіонарна трансартеріальна емболізація або процедури хемоінфузії – 44 %;
променева терапія перед лікуванням кабозантінібом – 37 %;
медіана тривалості лікування сорафенібом – 5,32 місяця;
72 % пацієнтів отримували одну, а 28 % – 2 попередні схеми системної терапії для лікування розповсюдженої форми захворювання.
Статистично значуще поліпшення загальної виживаності було продемонстровано для лікарського засобу КАБОМЕТИКС відносно плацебо (таблиця 4, рисунок 4).
Дані стосовно виживаності без прогресування захворювання та показник об’єктивної відповіді представлено в таблиці 4.
Таблиця 4
Результати ефективності у пацієнтів з ГЦК (популяція ITT, дослідження CELESTIAL)
|
Показник |
КАБОМЕТИКС (N = 470) |
Плацебо (N = 237) |
|
Загальна виживаність |
||
|
Медіана загальної виживаності (95 % ДІ), місяці |
10,2 (9,1; 12,0) |
8,0 (6,8; 9,4) |
|
HR (95 % ДІ)1,2 |
0,76 (0,63; 0,92) |
|
|
p-значення 1 |
p = 0,0049 |
|
|
Виживаність без прогресування захворювання3 |
||
|
Медіана виживаності без прогресування (95 % ДІ) |
5,2 (4,0; 5,5) |
1,9 (1,9; 1,9) |
|
HR (95 % ДІ)1 |
0,44 (0,36; 0,52) |
|
|
p-значення1 |
p < 0,0001 |
|
|
Розрахунок частки пацієнтів без певних подій через 3 місяці після лікування (метод Каплана – Мейєра) |
||
|
% (95 % ДІ) |
67,0 % (62,2 %; 71,3 %) |
33,3 % (27,1 %; 39,7 %) |
|
Показник об’єктивної відповіді, n (%)3 |
||
|
Повні відповіді (CR) |
0 |
0 |
|
Часткові відповіді (PR) |
18 (4) |
1 (0,4) |
|
Об’єктивна відповідь (CR+PR) |
18 (4) |
1 (0,4) |
|
p-значення1,4 |
p = 0,0086 |
|
|
Стабілізація захворювання |
282 (60) |
78 (33) |
|
Прогресування захворювання |
98 (21) |
131 (55) |
1 2-сторонній, стратифікований, логарифмічний ранговий критерій, в якому факторами стратифікації є етіологія захворювання (вірус гепатиту В [з або без вірусу гепатиту С], вірус гепатиту С [без вірусу гепатиту В] або інша категорія пацієнтів), географічний регіон (Азія, інші регіони) та наявність екстрагепатичного поширення захворювання та/або макроваскулярних інвазій (так/ні) (за даними IVRS).
2 Розраховано на основі моделі пропорційних ризиків Кокса.
3 За оцінкою дослідника відповідно до критеріїв RECIST 1.1.
4 Стратифікований критерій Кохрана – Мантеля – Гензеля (CMH).
|
Місяці |
|
КАБОМЕТИКС Плацебо |
|
Кількість пацієнтів групи ризику КАБОМЕТИКС Плацебо |
Рис. 4. Крива загальної виживаності (метод Каплана – Мейєра, дослідження CELESTIAL)
|
Місяці |
|
Кількість пацієнтів групи ризику КАБОМЕТИКС Плацебо |
|
КАБОМЕТИКС Плацебо |
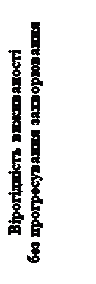
Рис. 5. Крива виживаності без прогресування захворювання (метод Каплана – Мейєра, дослідження CELESTIAL)
Частка системної непроменевої і локальної, спрямованої на печінку системної протипухлинної терапії не за протоколом (NPACT) становила 26 % у групі застосування кабозантінібу і 33 % у групі плацебо. Пацієнтам, які отримували такі види терапії, довелося припинити лікування досліджуваним режимом. Пошуковий аналіз загальної виживаності з цензуруванням даних за застосуванням NPACT забезпечив дані на підтримку результатів первинного аналізу: показник HR, скоригований на фактори стратифікації (на IxRS), становив 0,66 (95 % ДІ: 0,52, 0,84; стратифіковане логарифмічне рангове p-значення 0,0005). Розрахована середня тривалість загальної виживаності методом Каплана – Мейєра становила 11,1 місяця в групі кабозантінібу порівняно з 6,9 місяця в групі плацебо, що дає розрахункову відмінність у медіанах на рівні 4,2 місяця.
Якість життя оцінювали без прив’язки до конкретного захворювання (QoL) за допомогою опитувальника EuroQoL EQ-5D-5L. Негативний вплив лікарського засобу КАБОМЕТИКС порівняно з плацебо на показник індексу корисності EQ-5D спостерігався протягом перших тижнів лікування. Після цього періоду доступні лише обмежені дані QoL.
Педіатрична популяція
Європейське агентство з лікарських засобів скасувало зобов’язання представити результати досліджень лікарського засобу КАБОМЕТИКС у всіх підгрупах педіатричної популяції щодо лікування гепатоцелюлярної карциноми, а також карцином нирок і ниркової миски (за винятком нефробластоми, нефробластоматозу, світлоклітинної саркоми, мезобластної нефроми, ниркової медулярної карциноми та рабдоїдної пухлини нирок) (див. розділ «Спосіб застосування та дози» стосовно інформації про застосування лікарського засобу дітям).
Фармакокінетика.
Абсорбція
Після перорального введення пікова концентрація кабозантінібу в плазмі досягається через 3–4 години. Профілі концентрація в плазмі залежно від часу показують другий пік абсорбції приблизно через 24 години після введення, що свідчить про те, що кабозантініб може пройти кишково-печінкову рециркуляцію.
Повторне щоденне застосування кабозантінібу у дозі 140 мг протягом 19 днів призвело до збільшення середнього накопичення кабозантінібу приблизно в 4–5 разів (на основі площі під фармакокінетичною кривою «концентрація–час») у порівнянні з одноразовим введенням дози; стабільний стан досягнуто приблизно на 15 день.
Їжа з високим вмістом жиру помірно підвищила максимальну концентрацію діючої речовини в плазмі крові та значення площі під фармакокінетичною кривою «концентрація–час» (41 % та 57 % відповідно) у порівнянні зі станами натще у здорових добровольців, які приймали перорально одну дозу кабозантінібу, що становила 140 мг. Інформація про вплив їжі, прийнятої через 1 годину після введення кабозантінібу, відсутня.
Біологічна еквівалентність не могла бути продемонстрована між кабозантінібом у капсулах та у таблетках після введення разової дози 140 мг здоровим добровольцям. Спостерігалося збільшення на 19 % максимальної концентрації діючої речовини в плазмі крові після введення таблетки (КАБОМЕТИКС) у порівнянні з капсулою (КОМЕТРИК). Менш ніж 10 % різниця показників площі під фармакокінетичною кривою «концентрація–час» спостерігалася після прийому таблеток кабозантінібу (КАБОМЕТИКС) та капсул (КОМЕТРИК).
Розподіл
Кабозантініб має високий ступінь зв’язування із білком плазми людини (≥ 99,7 %). На підставі виміру фармакокінетичних показників об’єм розподілу (Vz) становить приблизно 212 л. Зв’язування з білками плазми не змінювалось у пацієнтів з легкими або помірними порушеннями функції нирок або печінки.
Біотрансформація
Кабозантініб метаболізується in vivo. Чотири метаболіти були наявні в плазмі при рівнях впливу (площа під фармакокінетичною кривою «концентрація–час») більше 10 % від вихідних метаболітів: XL184-N-оксид, продукт розщеплення аміду XL184, моногідроксисульфат XL184 та сульфат продукту розщеплення 6-десметил аміду. Два некон’юговані метаболіти (XL184-N-оксид та продукт розщеплення аміду XL184) мають < 1 % цільової активності пригнічення кінази вихідного кабозантінібу, кожен з них становить < 10 % загального впливу на плазму крові, пов’язаного з лікарським засобом.
Кабозантініб являє собою субстрат для метаболізму CYP3A4 in vitro, оскільки нейтралізуюче антитіло до CYP3A4 пригнічує утворення метаболіту XL184-N-оксиду на > 80 % в мікросомальній інкубації печінки людини, каталізованій NADPH; для порівняння, нейтралізуючі антитіла до CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C19, CYP2D6 та CYP2E1 не впливали на утворення метаболітів кабозантінібу. Нейтралізуюче антитіло до CYP2C9 показало мінімальний вплив на утворення метаболіту кабозантінібу (тобто зниження на < 20 %).
Виведення
При пероральному застосуванні кабозантінібу в дозах від 20 мг до 140 мг середній час його напіввиведення з плазми крові за даними досліджень за участю 1883 пацієнтів і 140 здорових добровольців становить близько 110 годин. Середній плазмовий кліренс (уявний кліренс) дорівнює майже 2,48 л/год після стабільної експозиції. Близько 81 % міченої ізотопами дози виявляли протягом 48 діб після застосування одноразової дози 14C-кабозантінібу у здорових добровольців, при цьому майже 54 % дози виводилося з фекаліями, а близько 27 % – виводилося із сечею.
Фармакокінетика у особливих груп пацієнтів
Ниркова недостатність
Результати дослідження за участю пацієнтів з нирковою недостатністю, яким застосовували одноразову дозу кабозантінібу 60 мг, вказують на те, що співвідношення середнього геометричного значення, розрахованого методом найменших квадратів, для кабозантінібу в плазмі крові, максимальної концентрації діючої речовини в плазмі крові та площі під фармакокінетичною кривою «концентрація – час» від 0 до безкінечності були на 19 % та 30 % вищими у пацієнтів з легкою формою ниркової недостатності (ДІ 90 % для максимальної концентрації діючої речовини в плазмі крові від 91,60 % до 155,51 %; площі під фармакокінетичною кривою, яка описує залежність «концентрація–час», від 0 до безкінечності від 98,79 % до 171,26 %) та на 2 % і на 6–7 % вищими (ДІ 90 % для максимальної концентрації діючої речовини в плазмі крові від 78,64 % до 133,52 %, площі під фармакокінетичною кривою «концентрація – час» від 0 до безкінечності від 79,61 % до 140,11 %) у пацієнтів з помірним ступенем ниркової недостатності в порівнянні з пацієнтами з нормальною функцією нирок. Пацієнти з гострою нирковою недостатністю не вивчалися.
Печінкова недостатність
За результатами інтегрованого аналізу популяційної фармакокінетики кабозантінібу у здорових добровольців та хворих на рак (у т. ч. ГЦК) клінічно значущої відмінності середнього рівня експозиції кабозантінібу в плазмі не спостерігали у пацієнтів з нормальною функцією печінки (n = 1425) та пацієнтів легкою формою печінкової недостатності (n = 558). Дані стосовно пацієнтів із середньою формою печінкової недостатності (n = 15) за критеріями NCI-ODWG (Робочої групи з питань дисфункцій органів при Національному інституті раку (США)) є обмеженими. Фармакокінетику кабозантінібу не оцінювали у пацієнтів з печінковою недостатністю тяжкого ступеня.
Раса
Популяційний фармакокінетичний аналіз не виявив клінічно значущих розбіжностей в фармакокінетиці кабозантінібу залежно від раси пацієнта.
Клінічні характеристики.
Показання.
Нирковоклітинна карцинома (НКК)
КАБОМЕТИКС показаний для лікування розповсюдженої нирковоклітинної карциноми (НКК):
- у дорослих пацієнтів, які раніше не отримували лікування і мають середній або високий ризик (див. розділ «Фармакодинамічні властивості»);
- у дорослих пацієнтів після попереднього лікування засобами, які впливають на фактор росту ендотелію судин (VEGF).
Гепатоцелюлярна карцинома (ГЦК)
КАБОМЕТИКС показаний як монотерапія гепатоцелюлярної карциноми (ГЦК) у дорослих пацієнтів, які раніше отримували лікування сорафенібом.
Протипоказання.
Гіперчутливість до діючої речовини або до будь-якої з допоміжних речовин лікарського засобу.
Взаємодія з іншими лікарськими засобами та інші види взаємодій.
Вплив інших лікарських засобів на кабозантініб
Інгібітори та індуктори CYP3A4
Попередній прийом кетоконазолу, потужного інгібітора CYP3A4, у дозі 400 мг 1 раз на добу протягом 27 днів перед застосуванням разової дози кабозантінібу збільшував вміст кабозантінібу в плазмі крові на 38 % (AUC) та зменшував кліренс кабозантінібу на 29 % у здорових добровольців. Потужні інгібітори CYP3A4 слід застосовувати з обережністю (включаючи ритонавір, ітраконазол, еритроміцин, кларитроміцин, грейпфрутовий сік).
Попередній прийом рифампіцину, потужного індуктора CYP3A4, у дозі 600 мг 1 раз на добу протягом 31 днів перед застосуванням разової дози кабозантінібу зменшував вміст кабозантінібу в плазмі крові на 77 % (AUC) та збільшував кліренс кабозантінібу в 4,3 раза у здорових добровольців. Слід уникати постійного одночасного введення потужних індукторів CYP3A4 (включаючи рифампіцин, карбамазепін, фенітоїн, фенобарбітал або лікарські засоби, що містять звіробій (Hypericum perforatum)).
Регулятори рН шлунково-кишкового тракту
Попередній прийом езомепразолу, інгібітора протонної помпи (ІПП), у дозі 40 мг 1 раз на добу протягом 6 днів перед застосуванням разової дози кабозантінібу 100 мг вказує на те, що це не має клінічно значущого впливу на вміст кабозантінібу в плазмі крові (AUC) у здорових добровольців. При одночасному введенні кабозантінібу з агентами, що змінюють рН шлунка, корегування дози не рекомендується (включаючи ІПП, антагоністи рецепторів Н2 та антациди).
Інгібітори MRP2
Дані досліджень in vitro вказують, що кабозантініб є субстратом MRP2. Тому введення інгібіторів MRP2 може призвести до збільшення концентрації кабозантінібу в плазмі.
Секвестранти жовчних кислот
Секвестранти, такі як холестирамін та холестагель, можуть вступати в реакцію з кабозантінібом та впливати на поглинання (або реабсорбцію), знижуючи дозу, що є несприятливим впливом (див. розділ «Фармакодинамика»). Клінічне значення цих потенційних впливів невідоме.
Вплив кабозантінібу на інші лікарські засоби
Вплив кабозантінібу на фармакокінетику протизаплідних стероїдів не досліджувався. Оскільки контрацептивний ефект не може бути гарантований, рекомендується використовувати додатковий метод контрацепції, зокрема бар’єрний.
Через високі рівні зв’язування кабозантінібу з білками плазми крові (див. розділ «Фармакокінетика») можлива взаємодія з варфарином – заміщення протеїнів плазми. У такому випадку слід контролювати показники міжнародного коефіцієнта нормалізації (INR).
Інгібітори P-глікопротеїну
Кабозантініб є інгібітором (IC50 = 7,0 mМ), але не субстратом P-глікопротеїнової (P-gp) транспортної активності в двонаправленій системі з використанням клітин, сконструйованих для експресії Р-глікопротеїну (MDCK-MDR1). Одночасне застосування інгібіторів P-gp може збільшувати концентрацію кабозантінібу у плазмі крові. Пацієнтів слід попереджати про прийом лікарських засобів, які вливають на Р-gp (таких як фексофенадин, аліскірен, амбрисентан, дабігатрану етексилат, дигоксин, колхіцин, маравірок, позаконазол, ранолазин, саксагліптин, ситагліптин, талінолол, толваптан), під час прийому кабозантінібу.
Особливості застосування.
Оскільки більшість побічних реакцій можуть виникати на початку лікування, необхідний ретельний контроль протягом перших восьми тижнів лікування з метою виявлення побічних реакцій та підвищеної індивідуальної чутливості до лікарського засобу щодо можливої модифікації дози. Події, що зазвичай мають ранній початок, включають гіпокальціємію, гіпокаліємію, тромбоцитопенію, артеріальну гіпертензію, синдром долонно-підошовної еритродизестезії (СДПЕ), протеїнурію та розлади шлунково-кишкового тракту (біль у животі, запалення слизової оболонки, запор, діарея, блювання).
Для лікування підозрюваних побічних реакцій може бути потрібна тимчасова перерва в прийомі препарату або зниження дози кабозантінібу (див. розділ «Спосіб застосування та дози»).
Під час базисного клінічного дослідження (дослідження METEOR) 59,8 % та 70 % пацієнтів з нирковоклітинною карциномою після попереднього лікування засобами, які впливають на фактор росту ендотелію судин (VEGF), потребували відповідно зниження дози та переривання терапії внаслідок побічних реакцій. Для 19,3 % пацієнтів було потрібно два зниження дози. Середній час до першого зниження дози становив 55 днів, а до переривання першої дози– 38 днів.
У пацієнтів з нирковоклітинною карциномою, які раніше не отримували лікування, зниження дози та переривання терапії проведено відповідно у 46 % та 73 % пацієнтів, які отримували кабозантініб у клінічному випробуванні (дослідження CABOSUN).
При лікуванні гепатоцелюлярної карциноми після попередньої системної терапії зниження дози та припинення терапії відбулося відповідно у 62 % та 84 % пацієнтів, які отримували кабозантініб у клінічному випробуванні (дослідження CELESTIAL). Для 33 % пацієнтів було потрібно два зниження дози. Середній час до першого зниження дози становив 38 днів, а до переривання першої дози – 28 днів. Для пацієнтів з печінковою недостатністю легкого або помірного ступеня рекомендовано забезпечити більш ретельний моніторинг.
Вплив на гепатобіліарну систему
Атипові результати функціональних печінкових проб (підвищення рівнів аланінамінотрансферази (АЛТ), аспартатамінотрансферази (АСТ) та білірубіну) часто спостерігають у пацієнтів, які отримують лікування кабозантінібом. Перед початком лікування кабозантінібом рекомендовано провести функціональні печінкові проби (АЛТ, АСТ, білірубін) та забезпечити ретельний моніторинг цих параметрів під час лікування. У разі погіршення результатів функціональних печінкових проб у зв’язку з лікуванням кабозантінібом (тобто за відсутності альтернативної причини) слід дотримуватися рекомендацій з модифікації дози, які представлено в таблиці 5 (див. розділ «Спосіб застосування та дози»).
Кабозантініб виводиться переважно печінкою. Для пацієнтів з печінковою недостатністю легкого або помірного ступеня рекомендовано забезпечити більш ретельний моніторинг загальної безпеки (див. також розділи «Особливості застосування» та «Фармакокінетика»). Печінкова енцефалопатія на тлі лікування кабозантінібом з’являлася у відносно більшої частки пацієнтів з печінковою недостатністю помірного ступеня (В за шкалою Чайлда – П’ю). КАБОМЕТИКС не рекомендовано застосовувати пацієнтам з печінковою недостатністю тяжкого ступеня (С за шкалою Чайлда – П’ю), оскільки кабозантініб не вивчався в цій популяції і його експозиція може збільшуватися у цих пацієнтів.
Печінкова енцефалопатія
У дослідженні ГЦК (дослідження CELESTIAL) про випадки печінкової енцефалопатії повідомляли частіше в групі кабозантінібу, аніж в групі плацебо. На фоні застосування кабозантінібу виникала діарея, блювання, зниження апетиту та порушення електролітного балансу. У пацієнтів з ГЦК та порушенням функції печінки ці реакції з боку інших систем і органів можуть бути передвісниками розвитку печінкової енцефалопатії. Рекомендовано контролювати стан пацієнта щодо виникнення ознак і симптомів печінкової енцефалопатії.
Перфорації та фістули
При лікуванні кабозантінібом відмічалися серйозні перфорації шлунково-кишкового тракту (ШКТ) та фістули, зокрема з летальними наслідками. Стан пацієнтів із запальним захворюванням кишечника (наприклад з хворобою Крона, виразковим колітом, перитонітом, дивертикулітом або апендицитом), інфільтрацією пухлини у ШКТ або ускладненнями від попередньої хірургії ШКТ (особливо коли це пов’язано з уповільненим або неповним загоєнням рани) слід ретельно оцінити перед початком лікування кабозантінібом та контролювати під час лікування щодо виникнення симптомів перфорацій і фістул, включаючи абсцеси та сепсис. Постійна або періодична діарея під час лікування може бути фактором ризику розвитку фістули прямої кишки. Лікування кабозантінібом слід повністю припинити пацієнтам, у яких з’явилася перфорація ШКТ або фістула, яку не вдається належним чином вилікувати.
Розлади з боку шлунково-кишкового тракту (ШКТ)
Діарея, нудота/блювання, зниження апетиту, а також стоматит/біль у ротовій порожнині є найчастішими повідомленими побічними реакціями з боку ШКТ (див. розділ «Побічні реакції»). Для попередження зневоднення, порушення електролітного балансу та втрати ваги слід призначити невідкладне медикаментозне лікування, зокрема підтримуючу терапію антиеметиками, протидіарейними засобами та антацидами. У разі постійних або рецидивних побічних реакцій з боку ШКТ слід розглянути доцільність призупинення терапії або зниження дози чи повної відміни кабозантінібу (див. таблицю 5).
Тромбоемболічні події
Під час лікування кабозантінібом спостерігали епізоди венозної тромбоемболії, включаючи легеневу емболію та артеріальну тромбоемболію, іноді з летальним наслідком. Пацієнтам з високим ризиком появи епізодів тромбоемболії або пацієнтам з наявністю цих епізодів в анамнезі слід призначати кабозантініб з обережністю. У дослідженні ГЦК (CELESTIAL) на тлі лікування кабозантінібом спостерігали тромбоз портальної вени, у тому числі один випадок з летальним наслідком. Пацієнти з інвазією портальної вени в анамнезі, найімовірніше, зазнають більшого ризику розвитку тромбозу портальної вени. Пацієнтам з гострим інфарктом міокарда або з будь-яким іншим клінічно значущим тромбоемболічним ускладненням застосування кабозантінібу слід припинити.
Кровотечі
При прийомі кабозантінібу зареєстровано випадки тяжких кровотеч, іноді з летальним наслідком. Перед початком лікування кабозантінібом стан пацієнтів, які мають в анамнезі тяжку кровотечу, потрібно ретельно оцінити.
Кабозантініб не слід призначати пацієнтам, у яких є важка кровотеча або є ризик її виникнення.
У дослідженні ГЦК (CELESTIAL) випадки кровотеч з летальними наслідками, були зареєстровані з вищою частотою при застосуванні кабозантінібу, ніж при застосуванні плацебо. Фактори ризику тяжких кровотеч у пацієнтів з розповсюдженою ГЦК можуть включати інвазію пухлини у великі кровоносні судини та наявність цирозу печінки, що призводить до варикозу вен стравоходу, портальної гіпертензії та тромбоцитопенії. У дослідження CELESTIAL не набирали пацієнтів з супутнім лікуванням антикоагулянтами або антитромбоцитарними засобами.
Також у це дослідження не включали пацієнтів, яким не лікували або повністю не вилікували варикоз з кровотечею або високим ризиком кровотечі.
Аневризми та розшарування артерій
Застосування інгібіторів шляху VEGF у пацієнтів з гіпертензією або без неї може сприяти формуванню аневризм та/або розшаруванню артерій. Перед початком прийому препарату цей ризик слід ретельно розглянути у пацієнтів з такими факторами ризику, як гіпертензія або аневризма в анамнезі.
Тромбоцитопенія
У дослідженні ГЦК (CELESTIAL) повідомляли про випадки тромбоцитопенії та зниження рівнів тромбоцитів. Під час лікування кабозантінібом слід контролювати рівні тромбоцитів та скорегувати дозування відповідно до ступеня тяжкості тромбоцитопенії (див. таблицю 5).
Ускладнення при загоєнні ран
Зареєстровано випадки ускладнення процесу загоєння ран при прийомі кабозантінібу. Рекомендується припинити терапію кабозантінібом за 28 днів до планової операції, включаючи хірургічну стоматологію або інвазивні стоматологічні процедури, якщо можливо. Рішення про відновлення лікування кабозантінібом після проведення хірургічних втручань необхідно приймати, зважаючи на клінічну оцінку процесу загоєння рани. Пацієнтам з ускладненням процесу загоєння ран, що потребують медичного втручання, лікування кабозантінібом слід припинити.
Артеріальна гіпертензія
Застосування кабозантінібу асоціювалося із підвищенням артеріального тиску із розвитком гіпертонічного кризу. Перед початком лікування кабозантінібом необхідно ретельно стабілізувати артеріальний тиск. Після початку застосування кабозантінібу усім пацієнтам слід здійснювати регулярний моніторинг артеріального тиску та у разі необхідності проводити лікування стандартною антигіпертензивною терапією. У разі тяжкої або стійкої артеріальної гіпертензії, що зберігається не зважаючи на застосування антигіпертензивних засобів, лікарю необхідно прийняти рішення про припинення лікування кабозантинібом, доки артеріальний тиск не буде під контролем, після чого можна відновити прийом кабозантинібу у зменшеній дозі.
У разі гіпертонічного кризу лікування кабозантінібом слід припинити.
Остеонекроз
Випадки остеонекрозу щелепи (ОНЩ) спостерігалися при застосуванні кабозантінібу. Перед початком прийому кабозантінібу та періодично під час терапії кабозантінібом слід проводити огляд ротової порожнини. Пацієнтів слід проінформувати щодо гігієни ротової порожнини. Лікування кабозантінібом слід проводити принаймні за 28 днів до запланованої стоматологічної операції або інвазивних стоматологічних процедур, якщо це можливо. Слід бути обережними пацієнтам, які отримують засоби, пов’язані з ОНЩ, такі як бісфосфонати. Кабозантініб слід припинити застосовувати пацієнтам, у яких виникав ОНЩ.
Синдром долонно-підошовної еритродизестезії (СДПЕ)
Випадки виникнення синдрому долонно-підошовної еритродизестезії (СДПЕ) були зареєстровано у пацієнтів, які отримували кабозантініб. При тяжкому СДПЕ слід враховувати можливість припинення лікування кабозантінібом. У випадках появи долонно-підошовного синдрому прийом кабозантінібу слід припинити до зникнення симптомів або їх зменшення до 1 ступеня.
Протеїнурія
Під час лікування кабозантінібом повідомлялося про випадки виникнення протеїнурії. Під час лікування кабозантінібом потрібно регулярно контролювати вміст білка в сечі. Кабозантініб слід відмінити, якщо у пацієнта розвивається нефротичний синдром.
Синдром оборотної задньої енцефалопатії (СОЗЕ)
Синдром оборотної задньої енцефалопатії (СОЗЕ) був зареєстровані у пацієнтів, які отримували кабозантініб. СОЗЕ може супроводжуватися судомами, порушенням зору, головним болем, сплутаністю свідомості та неврологічними розладами. Пацієнтам із СОЗЕ рекомендується припинити лікування кабозантінібом.
Подовження інтервалу QT
Кабозантініб рекомендується застосовувати із обережністю пацієнтам з подовженням інтервалу QT в анамнезі, які приймають лікарські засоби, що сприяють подовженню інтервалу QT, та пацієнтам з відповідними попередніми серцевими захворюваннями, брадикардією або порушеннями електролітного балансу. При застосуванні кабозантінібу потрібен періодичний моніторинг за допомогою ЕКГ і визначення сироваткових концентрацій калію, кальцію, магнію.
Порушення функції щитовидної залози
Усім пацієнтам рекомендований лабораторний контроль щитовидної залози до початку застосування лікарського засобу. Пацієнти з наявним гіпотиреозом або гіпертиреозом повинні проходити лікування відповідно до стандартної медичної практики до початку терапії кабозантінібом. Під час лікування кабозантінібом за станом усіх пацієнтів слід уважно спостерігати щодо виникнення ознак та симптомів дисфункції щитовидної залози та періодично контролювати у них роботу щитовидної залози. Пацієнти, у яких розвивається дисфункція щитовидної залози, повинні лікуватися відповідно до стандартної медичної практики залежно від типу виявленої дисфункції.
Атипові результати біохімічного аналізу крові
Застосування кабозантінібу пов’язане з підвищеною частотою порушення електролітного балансу (включаючи гіпо- та гіперкаліємію, гіпомагніємію, гіпокальціємію, гіпонатріємію). Рекомендовано контролювати параметри біохімічного аналізу крові під час лікування кабозантінібом, а за потреби – призначити відповідну замісну терапію згідно зі стандартами клінічної практики. Випадки печінкової енцефалопатії у пацієнтів з ГЦК можна пояснити порушенням електролітного балансу, що з’являється на тлі лікування. Якщо серйозні відхилення лабораторних параметрів від норми зберігаються або періодично повторюються, необхідно розглянути доцільність призупинення терапії, зменшення дози чи повної відміни кабозантінібу (див. таблицю 5).
Інгібітори та індуктори CYP3A4.
Кабозантініб є субстратом для CYP3A4. Одночасний прийом кабозантінібу та інгібітора CYРЗА4 кетоконазолу може призвести до вираженого збільшення експозиції кабозантінібу. Особлива обережність потрібна при застосуванні агентів, що є сильними інгібіторами CYP3A4, одночасно з кабозантінібом. Одночасне застосування кабозантінібу з потужними індукторами CYP3A4, наприклад з рифампіцином, може зменшувати експозицію і розподіл кабозантінібу. Тому слід уникати супутнього введення агентів, які є сильними індукторами CYP3A4, та кабозантінібу (див. розділи «Спосіб застосування та дози» і «Взаємодія з іншими лікарськими засобами та інші види взаємодій»).
Субстрат P-глікопротеїну
Кабозантініб є інгібітором (IC50 = 7,0 mМ), але не субстратом P-глікопротеїну (P-gp) транспортної активності в двонаправленій системі з використанням клітин, сконструйованих для експресії Р-глікопротеїну (MDCK–MDR1). Одночасне застосування інгібіторів P-gp може збільшувати концентрацію кабозантінібу у плазмі крові. Пацієнтів слід попереджати про прийом лікарських засобів, що впливають на Р-gp (таких як фексофенадин, аліскірен, амбрисентан, дабігатрану етексилат, дигоксин, колхіцин, маравірок, позаконазол, ранолазин, саксагліптин, ситагліптин, талінолол, толваптан), під час прийому кабозантінібу (див. розділ «Взаємодія з лікарськими засобами та інші види взаємодій»).
Інгібітори MRP2
Введення інгібіторів MRP2 може збільшувати концентрацію кабозантінібу в плазмі крові. Інгібітори MRP2 слід застосовувати обережно (включаючи циклоспорин, ефавіренз, емтрицитабін) (див. розділ «Взаємодія з лікарськими засобами та інші види взаємодій»).
Застереження щодо допоміжних речовин
Пацієнти з рідкісною спадковою непереносимістю галактози, повною лактазною недостатністю або мальабсорбцією глюкози-галактози не повинні приймати цей лікарський засіб.
1 таблетка, вкрита плівковою оболонкою, по 20 мг містить 15,54 мг лактози.
1 таблетка, вкрита плівковою оболонкою, по 40 мг містить 31,07 мг лактози.
1 таблетка, вкрита плівковою оболонкою, по 60 мг містить 46,61 мг лактози.
Сполуки натрію
Цей лікарський засіб містить менше ніж 1 ммоль натрію (23 мг) на таблетку, тобто є практично вільним від натрію.
Будь-які залишки невикористаного лікарського засобу або відходи потрібно утилізувати відповідно до стандартів лікарняної практики.
Застосування у період вагітності або годування груддю.
Жінки репродуктивного віку/контрацепція для чоловіків і жінок
Жінкам репродуктивного віку під час лікування кабозантінібом слід уникати вагітності. Жінкам, партнери яких застосовують кабозантініб, слід уникати вагітності. Жінки репродуктивного віку та чоловіки повинні використовувати ефективні методи контрацепції протягом лікування та 4 місяців після завершення курсу лікування. Оскільки пероральні контрацептиви, можливо, не вважатимуться ефективними методами контрацепції, у разі їх використання слід вживати інших запобіжних заходів (див. розділ «Взаємодія з лікарськими засобами та інші види взаємодій»).
Вагітність
Даних щодо застосування кабозантінібу вагітними жінками немає. Дослідження на тваринах показали ембріофетальний і тератогенний ефект. Потенційний ризик для людини невідомий. Кабозантініб не слід застосовувати протягом вагітності, окрім випадків нагальної клінічної необхідності.
Годування груддю
Невідомо, чи потрапляє кабозантініб або його метаболіти у грудне молоко людини. Не можна виключати ризик для немовляти, що перебуває на грудному вигодовуванні, тому під час лікування кабозантінібом та принаймні протягом 4 місяців після завершення лікування необхідно припинити грудне вигодовування.
Фертильність.
Даних щодо впливу кабозантінібу на фертильність людини немає. Результати досліджень вказують на те, що кабозантініб може негативно вплинути на фертильність у чоловіків та жінок. Чоловікам і жінкам необхідно використовувати ефективні методи контрацепції під час лікування.
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами.
Кабозантініб має незначний вплив на здатність керувати транспортними засобами або іншими механізмами. Під час лікування кабозантінібом деякі пацієнти повідомляли про побічні реакції, такі як стомлюваність та слабкість. Під час лікування необхідно дотримуватися обережності при керуванні автотранспортом або іншими механізмами.
Спосіб застосування та дози.
Лікування лікарським засобом КАБОМЕТИКС має призначати і проводити лікар, який має досвід призначення протипухлинних лікарських засобів.
Спосіб застосування
КАБОМЕТИКС призначений для перорального застосування. Таблетки ковтають цілими, не подрібнюючи. Пацієнтам не слід вживати їжу за 2 години до і принаймні 1 годину після прийому лікарського засобу КАБОМЕТИКС.
Дози
Таблетки КАБОМЕТИКС та капсули кабозантінібу не є біоеквівалентними та не повинні використовуватися як взаємозамінні (див. розділ «Фармакокінетика»).
Як монотерапія
Рекомендована доза лікарського засобу КАБОМЕТИКС для лікування НКК та ГЦК становить 60 мг один раз на добу. Лікування лікарським засобом слід продовжувати до моменту припинення отримання пацієнтом клінічних переваг від терапії або до моменту появи неприпустимих ознак токсичності.
Рекомендовані зміни дози
Виникнення підозрюваних побічних реакцій на лікарський засіб може потребувати тимчасового припинення лікування та/або зниження дози лікарського засобу КАБОМЕТИКС (див. таблицю 5). У разі необхідності дозу рекомендовано зменшити до 40 мг на добу, а потім до 20 мг на добу.
При розвитку токсичності 3 ступеня за класифікацією СТСАЕ (Єдині термінологічні критерії побічних реакцій) чи вище або при розвитку непереносимої токсичності 2 ступеня, необхідно тимчасово призупинити лікування. У разі виникнення серйозних або непереносимих проявів токсичності рекомендовано знизити дозу.
Пропущену дозу не слід приймати, якщо до прийому наступної дози залишилося менше 12 годин.
Таблиця 5
Рекомендовані модифікації доз лікарського засобу КАБОМЕТИКС та необхідні заходи в разі розвитку побічних реакцій
|
Побічна реакція та ступінь тяжкості |
Рекомендовані зміни дози та заходи |
|
Побічні реакції 1–2 ступеня, що добре переносяться та легко лікуються |
Непотрібно корегувати дозу. Розпочати підтримувальну терапію за показаннями. |
|
Побічні реакції 2 ступеня, які є непереносимими і не зникають після зниження дози або призначення підтримувальної терапії |
Припинити лікування, доки токсичність не знизиться до ≤ 1 ступеня. Показано розпочати підтримувальну терапію за показаннями. Розглянути можливість відновлення терапії у меншій дозі. |
|
Побічні реакції 3 ступеня (за винятком клінічно невідповідних лабораторних відхилень) |
Припинити лікування, доки токсичність не знизиться до ≤ 1 ступеня. Показано розпочати підтримувальну терапію за показаннями. Відновити терапію у меншій дозі. |
|
Побічні реакції 4 ступеня (за винятком клінічно невідповідних лабораторних відхилень) |
Призупинити лікування. Надати відповідну медичну допомогу. При зменшенні токсичності до ≤ 1 ступеня відновити терапію в меншій дозі. Якщо побічна реакція зберігається, остаточно відмінити лікування лікарським засобом КАБОМЕТИКС. |
Примітка: Критерії оцінки ступеня тяжкості побічних реакцій згідно NCI-CTCAE v4.
Супутні лікарські засоби
Слід із обережністю супутньо застосовувати лікарські засоби, які є сильними інгібіторами СYP3A4, та слід уникати постійного супутнього застосування лікарських засобів, які є сильними індукторами CYP3A4 (див. розділи «Особливості застосування» та «Взаємодія з іншими лікарськими засобами та інші види взаємодій»).
Слід враховувати вибір альтернативного супутнього лікарського засобу, який не має або має мінімальну інгібуючу активність щодо впливу на ізофермент CYP3A4.
Особливі групи пацієнтів
Пацієнти літнього віку
Не потребують корегування дози кабозантінібу пацієнти літнього віку (≥ 65 років).
Етнічна належність
Корегування дози залежно від етнічної належності пацієнта не потрібне (див. розділ «Фармакокінетика»).
Пацієнти з нирковою недостатністю
Кабозантініб слід призначати з обережністю пацієнтам з нирковою недостатністю легкого або помірного ступеня.
Кабозантініб протипоказаний пацієнтам з нирковою недостатністю тяжкого ступеня, оскільки безпека та ефективність кабозантінібу для цієї популяції хворих не встановлені.
Пацієнти з печінковою недостатністю
Пацієнтам з печінковою недостатністю легкого ступеня корегування дози непотрібне. Оскільки наявні лише обмежені дані про застосування кабозантінібу пацієнтам з печінковою недостатністю помірного ступеня (В за шкалою Чайлда – П’ю), неможливо дати рекомендацій щодо дозування. Для цих пацієнтів рекомендовано забезпечити моніторинг загальної безпеки (див. розділи «Особливості застосування» та «Фармакокінетика»). З огляду на відсутність клінічного досвіду застосування кабозантінібу пацієнтам з печінковою недостатністю тяжкого ступеня (С за шкалою Чайлда – П’ю) кабозантініб не рекомендовано застосовувати цій категорії пацієнтів (див. розділ «Фармакокінетика»).
Пацієнти із серцевою недостатністю
Дані щодо застосування пацієнтам із серцевою недостатністю обмежені. Не існує конкретних рекомендації щодо дозування для цієї популяції пацієнтів.
Діти.
Безпека та ефективність кабозантінібу для дітей та підлітків (< 18 років) не встановлені. Відповідні дані відсутні. Не застосовувати дітям.
Передозування.
Спеціального лікування при передозуванні кабозантінібом не існує, а можливі симптоми передозування не встановлені. При підозрі на передозування прийом кабозантінібу слід припинити і почати підтримуючу терапію. Необхідний контроль лабораторних біохімічних показників та параметрів метаболізму і моніторинг їх принаймні щотижня або у разі наявності для цього клінічних показань. Побічні реакції, пов’язані з передозуванням, лікують симптоматично.
Побічні реакції.
Короткий опис профілю безпеки
Найбільш поширеними серйозними побічними реакціями у пацієнтів з НКК (частота ≥ 1 %) є пневмонія, біль у животі, діарея, нудота, артеріальна гіпертензія, емболія, гіпонатріємія, емболія легень, блювання, зневоднення, втомлюваність, астенія, зниження апетиту, тромбоз глибоких вен, запаморочення, гіпомагніємія та синдром долонно-підошовної еритродизестезії (СДПЕ).
Найбільш поширеними побічними реакціями будь-якого ступеня (які спостерігали щонайменше у 25 % пацієнтів) у хворих на НКК були діарея, втомлюваність, нудота, зниження апетиту, СДПЕ, артеріальна гіпертензія, зниження маси тіла, блювання, дисгевзія, запор, підвищення АСТ. Артеріальну гіпертензію спостерігали частіше у пацієнтів з НКК, які раніше не отримували лікування (67 %), порівняно з хворими на НКК, яким раніше застосовували засоби, що впливають на VEGF (37 %).
Найбільш поширеними серйозними побічними реакціями у пацієнтів з ГЦК (частота ≥ 1 %) є печінкова енцефалопатія, астенія, втомлюваність, СДПЕ, діарея, гіпонатріємія, блювання, біль у животі та тромбоцитопенія.
Найбільш поширеними побічними реакціями будь-якого ступеня (які спостерігали щонайменше у 25 % пацієнтів) у хворих на ГЦК були діарея, зниження апетиту, втомлюваність, нудота, СДПЕ, артеріальна гіпертензія та блювання. Перелік побічних реакцій наведено у таблиці 6.
У таблиці 6 побічні реакції, що спостерігалися при застосуванні кабозантінібу в клінічних випробуваннях або у післяреєстраційний період, розподілено за класами систем органів згідно з термінологією MedDRA і класифіковано за частотою за даними про всі ступені тяжкості таким чином: дуже часто (≥ 1/10), часто (≥ 1/100 і < 1/10), нечасто (≥ 1/1000 і < 1/100), невідомо (неможливо визначити за наявними даними). У межах кожної групи за частотою побічні реакції представлено в порядку зменшення їхньої серйозності.
Таблиця 6
Побічні реакції на лікарський засіб (ПРЛЗ), зареєстровані при застосуванні кабозантінібу в клінічних дослідженнях або у післяреєстраційний період
|
Система органів (за MedDRA) |
Дуже часто |
Часто |
Нечасто |
Невідомо |
|
Інфекції та інвазії |
абсцес, пневмонія |
|||
|
З боку кровоносної та лімфатичної систем |
анемія, тромбо-цитопенія1 |
нейтропенія1, лімфопенія1 |
||
|
З боку органів ендокринної системи |
гіпотиреоз3 |
|||
|
З боку метаболізму та системи травлення |
зниження апетиту гіпомагніємія2 гіпокаліємія2 гіпоальбумі-немія2 |
дегідратація гіпофосфатемія2 гіпонатріємія2 гіпокальціємія2 гіперкаліємія3 гіпербілірубінемія3 гіперглікемія3 гіпоглікемія2 |
||
|
З боку нервової системи |
дисгевзія головний біль запаморочення |
периферична нейропатія (включаючи сенсорну) |
cудоми, церебро-васкулярне порушення синдром оборотної задньої енцефалопатії |
|
|
З боку органів слуху та рівноваги |
тинітус |
|||
|
З боку серця |
інфаркт міокарда |
|||
|
З боку судинної системи |
артеріальна гіпертензія5 крововиливи* |
венозний тромбоз |
гіпертонічний криз артеріальний тромбоз |
аневризми та розшарування артерій |
|
З боку дихальної системи, органів грудної клітки та середостіння |
дисфонія задишка кашель |
легенева емболія |
пневмоторакс |
|
|
З боку травної системи |
діарея* нудота блювання стоматит запор біль у животі,4 диспепсія |
гастроезофагеальний рефлюкс біль у ротовій порожнині сухість у роті дисфагія коліт гастрит геморой |
перфорація шлунково-кишкового тракту* фістула* панкреатит перфорація тонкої кишки, глосодинія |
|
|
З боку гепатобіліарної системи |
печінкова енцефалопатія* |
холестатичний гепатит |
||
|
З боку шкіри та підшкірної клітковини |
синдром долонно-підошовної еритродизес-тезії висипання |
свербіж алопеція сухість шкіри еритема акнеформний дерматит зміна кольору волосся гіперкератоз |
шкірний васкуліт |
|
|
З боку скелетно-м’язової системи і сполучної тканини |
біль у кінцівках |
м’язові спазми артралгія |
остеонекроз щелепи |
|
|
З боку нирок і сечовивідних шляхів |
протеїнурія |
|||
|
Загальні порушення |
втомлюваність запалення слизових оболонок астенія периферичний набряк |
|||
|
З боку лабораторних показників |
зниження маси тіла підвищення рівня аланінаміно-трансферази (AЛT) в сироватці крові підвищення рівня аспартатаміно-трансферази (AСT) в сироватці крові |
підвищення рівня лужної фосфатази (ЛФ) в крові підвищення рівня гамма-глутамілтрансферази (ГГТ) підвищення рівня креатиніну в крові підвищення рівня амілази підвищення рівня ліпази підвищення рівня холестерину в крові3 підвищення рівнів тригліцеридів в крові3 |
||
|
Травми, отруєння та ускладнення при проведенні процедур |
ускладнення загоєння ран6 |
* Опис вибраних побічних реакцій для подальшої характеристики.
Нижчезазначені терміни були об’єднані для відповідності класифікації частот:
1 Знижені гематологічні параметри: лімфопенія та зменшена кількість лімфоцитів; нейтропенія та зменшена кількість нейтрофілів; тромбоцитопенія та зменшена кількість тромбоцитів.
2 Знижені біохімічні показники: зниження гіпоальбумінемії та альбуміну в крові; гіпокальціємія та зниження вмісту кальцію в крові; гіпоглікемія та зменшений рівень глюкози в крові; гіпокаліємія та знижений вміст калію в крові; гіпомагніємія та зменшений вміст магнію в крові; гіпонатріємія та знижений вміст натрію в крові; гіпофосфатемія та зменшений вміст фосфору у крові.
3 Підвищені біохімічні показники: підвищений рівень холестерину в крові та гіперхолестеринемія; гіпербілірубінемія та підвищення рівня білірубіну у крові; гіперглікемія та підвищення рівня глюкози в крові; підвищений гіпотиреоз і тиреотропний гормон, що стимулює кров; гіперкаліємія та підвищений вміст калію в крові; збільшення рівня тригліцеридів та гіпертригліцеридемія.
4 Біль у животі, дискомфорт у животі, біль у животі у верхній частині та біль у животі внизу.
5 Гіпертонія та артеріальний тиск підвищується.
6 Порушення загоєння та ускладнення у місці розрізу.
Опис окремих побічних реакцій
Дані щодо нижчезазначених реакцій у пацієнтів, які приймали лікарський засіб КАБОМЕТИКС у дозі 60 мг на добу (перорально), отримані під час базисних досліджень за участю пацієнтів з НКК після терапії на основі лікарських засобів, які впливають на VEGF, та пацієнтів з НКК, які раніше не отримували лікування, а також за участю пацієнтів з ГЦК після попередньої системної терапії (див. розділ «Фармакодинаміка»).
Перфорація шлунково-кишкового тракту
У дослідженні НКК після застосування лікарських засобів, які впливають на VEGF (METEOR), перфорацію ШКТ ступеня 2 або 3 було зареєстровано у 0,9 % пацієнтів з нирковоклітинною карциномою, які отримували лікування кабозантінібом (у 3 з 331). Медіана часу до появи перфорацій становила 10 тижнів.
У дослідженні НКК за участю пацієнтів, які раніше не отримували лікування (CABOSUN), перфорацію ШКТ ступеня 4 та 5 виявили у 2,6 % (у 2 з 78) пацієнтів, які отримували кабозантініб.
У дослідженні ГЦК (CELESTIAL) перфорацію ШКТ ступеня 3 або 4 виявили у 0,9 % пацієнтів, яких лікували кабозантінібом (4 з 467). Медіана часу до появи перфорацій становила 5,9 тижня.
У клінічній програмі дослідження кабозантінібу відмічалися випадки перфорації з летальним наслідком.
Печінкова енцефалопатія
У дослідженні ГЦК (CELESTIAL) печінкову енцефалопатію (печінкову енцефалопатію, енцефалопатію, гіперамонімічну енцефалопатію) відмічали у 5,6 % пацієнтів, які отримували кабозантініб (26 з 467). Реакції ступеня 3–4 спостерігали у 2,8 %; також зафіксовано один випадок ступеня 5 (0,2 %). Медіана часу до розвитку енцефалопатії становила 5,9 тижня. У дослідженнях НКК (METEOR і CABOSUN) випадків печінкової енцефалопатії не зафіксовано.
Діарея
У дослідженні НКК після попередньої терапії засобами, які впливають на VEGF (METEOR), діарею виявлено у 74 % пацієнтів, які отримували кабозантініб (245 з 331). Реакції ступеня 3–4 становили 11 %. Медіана часу до появи діареї становила 4,9 тижня.
У дослідженні НКК за участю пацієнтів, які раніше не отримували лікування (CABOSUN), діарею спостерігали у 73 % пацієнтів, які отримували кабозантініб (57 з 78). Реакції ступеня 3–4 зафіксовано у 10 % випадків.
У дослідженні ГЦК (CELESTIAL) діарею спостерігали у 54 % пацієнтів, які отримували кабозантініб (251 з 467); реакції ступеня 3–4 зафіксовано у 9,9 %. Медіана часу до появи всіх цих випадків становила 4,1 тижня. Внаслідок діареї у 84 з 467 (18 %), 69 з 467 (15 %) та у 5 з 467 (1 %) пацієнтів відповідно довелося змінювати дозу, припинити терапію та повністю відмінити лікування.
Фістули
У дослідженні НКК після попередньої терапії засобами, які впливають на VEGF (METEOR), фістули спостерігалися у 1,2 % (у 4 з 331) пацієнтів, які приймали кабозантініб, зокрема фістули прямої кишки у 0,6 % (у 2 з 331). Один випадок класифіковано як побічну реакцію 3 ступеня, а решту – як реакції 2 ступеня. Медіана часу до появи фістули становила 30,3 тижня.
У дослідженні НКК за участю пацієнтів, які раніше не отримували лікування (CABOSUN), фістули не виявили.
У дослідженні ГЦК (CELESTIAL) фістули спостерігали у 1,5 % (7 з 467) хворих на ГЦК. Медіана часу до появи фістули становила 14 тижнів.
У програмі клінічної розробки кабозантінібу повідомляли про випадки фістул з летальними наслідками.
Кровотеча
У дослідженні НКК після попередньої терапії засобами, які впливають на VEGF (METEOR), частота виникнення тяжких геморагічних подій (ступінь ≥ 3) становила 2,1 % у пацієнтів з НКК, які отримували кабозантініб (у 7 з 331). Медіана часу до початку кровотечі становила 20,9 тижня.
У дослідженні НКК за участю пацієнтів, які раніше не отримували лікування (CABOSUN), частота виникнення тяжких геморагічних подій (ступінь ≥ 3) становила 5,1 % (4/78) у пацієнтів з НКК, які отримували кабозантініб.
У дослідженні ГЦК (CELESTIAL) частота виникнення тяжких геморагічних подій (ступінь ≥ 3) становила 7,3 % у пацієнтів, які отримували кабозантініб (34 з 467). Медіана часу до початку кровотечі становила 9,1 тижня.
У програмі клінічної розробки кабозантінібу повідомляли про випадки кровотечі з летальними наслідками.
Синдром оборотної задньої енцефалопатії (СОЗЕ)
У дослідженнях METEOR, CABOSUN чи CELESTIAL не було повідомлень про випадки СОЗЕ, але в інших клінічних дослідженнях зрідка повідомлялося про випадки СОЗЕ (у 2 з 4872 пацієнтів; 0,04 %).
Гіпотиреоз
У дослідженні НКК після застосування лікарських засобів, які впливають на VEGF (METEOR), випадки гіпотиреозу було зареєстровано у 21 % пацієнтів (у 68 з 331).
У дослідженні НКК за участю пацієнтів, які раніше не отримували лікування (CABOSUN), випадки гіпотиреозу було зареєстровано у 23 % пацієнтів (у 18 з 78), які отримували кабозантініб.
У дослідженні ГЦК (CELESTIAL) випадки гіпотиреозу було зареєстровано у 8,1 % пацієнтів (у 38 з 467), які отримували кабозантініб, та реакції ступеня 3 становили 0,4 % ( у 2 з 467).
Повідомлення про побічні реакції
Повідомлення про побічні реакції після реєстрації лікарського засобу має важливе значення. Це дає змогу проводити моніторинг співвідношення користь/ризик при застосування цього лікарського засобу. Медичним та фармацевтичним працівникам, а також пацієнтам, або їхнім законним представникам слід повідомляти про усі випадки підозрюваних побічних реакцій та відсутності ефективності лікарського засобу через Автоматизовану інформаційну систему з фармаконагляду за посиланням: https://aisf.dec.gov.ua
Термін придатності.
4 роки.
Умови зберігання.
Лікарський засіб не потребує особливих умов зберігання. Зберігати у недоступному для дітей місці.
Упаковка.
20 мг: по 7 таблеток, вкритих плівковою оболонкою, у блістері; по 4 блістери в картонній коробці або по 30 таблеток, вкритих плівковою оболонкою, у пляшці з поліетилену високої щільності (HDPE) з поліпропіленовим засобом, недоступним для відкривання дітьми, з трьома контейнерами з силікагелем-осушувачем по 1 г та поліефірним волокном; по 1 пляшці в картонній коробці;
40 мг: по 7 таблеток, вкритих плівковою оболонкою, у блістері; по 4 блістери в картонній коробці або по 30 таблеток, вкритих плівковою оболонкою, у пляшці з поліетилену високої щільності (HDPE) з поліпропіленовим засобом, недоступним для відкривання дітьми, з трьома контейнерами з силікагелем-осушувачем по 1 г та поліефірним волокном; по 1 пляшці в картонній коробці;
60 мг: по 7 таблеток, вкритих плівковою оболонкою, у блістері; по 4 блістери в картонній коробці або по 30 таблеток, вкритих плівковою оболонкою, у пляшці з поліетилену високої щільності (HDPE) з поліпропіленовим засобом, недоступним для відкривання дітьми, з трьома контейнерами з силікагелем-осушувачем по 1 г та поліефірним волокном; по 1 пляшці в картонній коробці.
Категорія відпуску.
За рецептом.
Виробники.
Роттендорф Фарма ГмбХ, Німеччина.
Патеон Франція.
Тджоапак Нідерланди Б.В.
Місцезнаходження виробників та адреса місця провадження їхньої діяльності.
Остенфелдер штрассе 51-61, Еннігерлох, Північний Рейн-Вестфалія, 59320, Німеччина.
40 бульвар де Шамперт, Бургуен-Жальє, 38300, Франція.
Ньюве Донк 9, ЕТТЕН-ЛЕУР, 4879АС, Нідерланди.
Заявник.
ІПСЕН ФАРМА.
Місцезнаходження заявника.
70, вул. Балард 75015 Париж, Франція






