Джардінс
- Список товарів
- Ціни в аптеках

Інструкція вказана для «Джардінс таблетки по 10 мг №30 (3 блістери х 10 таблеток)»
Склад:
діюча речовина: емпагліфлозин;
1 таблетка містить емпагліфлозину 10 мг або 25 мг;
допоміжні речовини: лактоза, моногідрат; целюлоза мікрокристалічна; гідроксипропілцелюлоза; натрію кроскармелоза; кремнію діоксид колоїдний безводний; магнію стеарат; оболонка Opadry® Yellow 02B38190 (гіпромелоза 2910, титану діоксид (E171), тальк, макрогол 400, заліза оксид жовтий (E172)).
Лікарська форма. Таблетки, вкриті плівковою оболонкою.
Основні фізико-хімічні властивості:
таблетки по 10 мг: круглі двоопуклі таблетки, вкриті плівковою оболонкою, блідо-жовтого кольору зі скошеними краями, з тисненням символу компанії «Boehringer Ingelheim» на одній стороні та тисненням «S10» на іншій;
таблетки по 25 мг: овальні двоопуклі таблетки, вкриті плівковою оболонкою, блідо-жовтого кольору зі скошеними краями, з тисненням символу компанії «Boehringer Ingelheim» на одній стороні та тисненням «S25» на іншій.
Фармакотерапевтична група.
Препарати, що застосовуються при цукровому діабеті, інгібітори натрій-залежного ко-транспортера глюкози 2 типу (іНЗКТГ2). Код ATХ A10B К03.
Фармакологічні властивості.
Фармакодинаміка.
Механізм дії
Емпагліфлозин є оборотним сильнодіючим (IC50 1,3 нмоль) і селективним конкурентним інгібітором натрій-залежного ко-транспортера глюкози 2 (НЗКТГ-2). Емпагліфлозин не інгібує інші транспортери глюкози, які відіграють важливу роль у доставці глюкози у периферичні тканини, і є в 5000 разів більш селективним відносно НЗКТГ-2 порівняно з НЗКТГ-1, основним транспортером, відповідальним за поглинання глюкози в кишечнику. НЗКТГ-2 експресується на високому рівні в нирках, тоді як експресія в інших тканинах відсутня або дуже низька. Як основний транспортер він відповідає за реабсорбцію глюкози з просвіту канальців назад до кровотоку. У пацієнтів з цукровим діабетом 2 типу та гіперглікемією фільтрується і поглинається більша кількість глюкози.
Емпагліфлозин покращує глікемічний контроль у пацієнтів з цукровим діабетом 2 типу за рахунок зниження реабсорбції глюкози нирками. Кількість глюкози, що виводиться нирками шляхом цього глюкуретичного механізму, залежить від концентрації глюкози в крові і швидкості клубочкової фільтрації (ШКФ). Інгібування НЗКТГ-2 у пацієнтів з цукровим діабетом 2 типу та гіперглікемією призводить до підвищеної екскреції глюкози з сечею. Крім того, емпагліфлозин збільшує екскрецію натрію, що призводить до осмотичного діурезу та зменшує інтраваскулярний об’єм.
У пацієнтів з цукровим діабетом 2 типу екскреція глюкози збільшувалась одразу після першої дози емпагліфлозину і зберігалась протягом 24-годинного інтервалу дозування. Збільшення екскреції глюкози з сечею зберігалось в кінці 4-тижневого періоду лікування і в середньому становило близько 78 г/добу. Збільшення екскреції глюкози з сечею призводило до негайного зниження рівнів глюкози в плазмі крові у пацієнтів з цукровим діабетом 2 типу.
Емпагліфлозин покращує рівні глюкози в плазмі крові як натще, так і після прийому їжі. Механізм дії емпагліфлозину не залежить від функції β-клітин та шляху дії інсуліну, що сприяє зниженню ризику гіпоглікемії. Було відзначено покращення маркерів функції β-клітин, в тому числі гомеостатичної моделі оцінки функції β-клітин (HOMA-β). Крім того, виділення глюкози з сечею спричиняє втрату калорій, пов’язану зі зниженням жирів і зменшенням маси тіла. Глюкозурія, що спостерігалась при застосуванні емпагліфлозину, супроводжується діурезом, що може сприяти довготривалому і помірному зниженню артеріального тиску.
Емпагліфлозин також зменшує реабсорбцію натрію і збільшує доставку натрію до дистальних канальців. Це може впливати на декілька фізіологічних функцій, включаючи, але не обмежуючись, збільшенням канальцево-клубочкового зворотного зв’язку та зниження внутрішньоклубочкового тиску, зниження перед/постнавантаження серця та попередження симпатичної активності, а також зниження навантаження на стінки лівого шлуночка, про що свідчать нижчі значення NT-proBNP, які можуть мати сприятливий вплив на ремоделювання серця, тиск наповнення та діастолічну функцію, а також збереження структури та функції нирок. Інші ефекти, такі як збільшення гематокриту, зниження маси тіла та артеріального тиску, можуть додатково сприяти отриманню користі для серця та нирок.
Клінічна ефективність та безпека
Цукровий діабет 2 типу
Покращення глікемічного контролю і зниження рівня серцево-судинних захворювань та смертності є невід’ємною частиною лікування цукрового діабету 2 типу.
Лікування емпагліфлозином окремо та в комбінації з метформіном, піоглітазоном, сульфонілсечовиною, інгібіторами ДПП-4 та інсуліном призводило до клінічно значущого покращення рівнів HbAlc, глюкози в плазмі крові натще, маси тіла, систолічного та діастолічного артеріального тиску. При застосуванні емпагліфлозину в дозі 25 мг підвищилася частка пацієнтів, які досягли цільового рівня HbA1c менше ніж 7%, і знизилася кількість пацієнтів, які потребували глікемічної терапії, у порівнянні із застосуванням емпагліфлозину в дозі 10 мг і плацебо. Чим вищим був рівень HbA1c на вихідному рівні, тим більшим було його зниження під дією препарату.
Крім того, емпагліфлозин як доповнення до стандартної терапії знижує рівень серцево-судинної смертності та серцево-судинних захворювань у пацієнтів із цукровим діабетом 2 типу.
Серцево-судинні прогнози
Подвійне сліпе плацебо - контрольоване дослідження EMPA-REG OUTCOME порівнювало ефективність застосування емпагліфлозину у дозах 10 мг та 25 мг та застосування плацебо, як доповнення до стандартної терапії пацієнтам із цукровим діабетом 2 типу та встановленими серцево-судинними захворюваннями.
Емпагліфлозин переважав плацебо у запобіганні смертності внаслідок серцево-судинних захворювань, нелетального інфаркту міокарда або нелетального інсульту. Ефект був обумовлений значним зниженням ризику серцево-судинної смертності без суттєвих змін щодо нелетального інфаркту міокарда або нелетального інсульту. Зниження смертності при серцево-судинних захворюваннях було порівнянним для емпагліфлозину 10 мг та 25 мг (див. графік нижче) і підтверджено покращенням загального виживання (табл. 1).
Вплив емпагліфлозину на первинну комбіновану кінцеву точку смерть внаслідок серцево-судинних захворювань, нелетального інфаркту міокарда або нелетального інсульту значною мірою не залежить від глікемічного контролю або функцій нирок, яка, як правило, у всіх категорій пацієнтів характеризувалася показником рШКФ від 30 мл/хв/1,73 м2 та вище в досліджені EMPA-REG OUTCOME.
Ефективність запобігання серцево-судинній смертності не була остаточно встановлена у пацієнтів, які застосовували емпагліфлозин одночасно з інгібіторами ДПП-4, та у пацієнтів негроїдної раси, оскільки представлення цих груп у дослідженні EMPA-REG OUTCOME було обмеженим.
Таблиця 1
Ефект лікування за основними критеріями оцінки, їх компонентами та смертністюа
|
Показник ефективності |
Плацебо N=2333 |
Емпагліфлозинb N=4687 |
|
Час до виникнення першого летального випадку внаслідок серцево-судинних захворювань, нелетального інфаркту міокарда або нелетального інсульту), N (%) |
282 (12,1) |
490 (10,5) |
|
Співвідношення ризиків у порівнянні з плацебо (95,02% довірчий інтервал (ДІ))* |
0,86 (0,74; 0,99) |
|
|
p-значення для переваги |
0,0382 |
|
|
Смерть внаслідок серцево-судинних захворювань, N (%) |
137 (5,9) |
172 (3,7) |
|
Співвідношення ризиків у порівнянні з плацебо (95% ДІ) |
0,62 (0,49; 0,77) |
|
|
p-значення |
<0.0001 |
|
|
Нелетальний інфаркт міокарда, N (%) |
121 (5,2) |
213 (4,5) |
|
Співвідношення ризиків у порівнянні з плацебо (95% ДІ) |
0,87 (0,70; 1,09) |
|
|
p-значення |
0,2189 |
|
|
Нелетальний інсульт, N (%) |
60 (2,6) |
150 (3,2) |
|
Співвідношення ризиків у порівнянні з плацебо (95% ДІ) |
1,24 (0,92; 1,67) |
|
|
p-значення |
0,1638 |
|
|
Загальна смертність, N (%) |
194 (8,3) |
269 (5,7) |
|
Співвідношення ризиків у порівнянні з плацебо (95% ДІ) |
0,68 (0,57; 0,82) |
|
|
p-значення |
<0.0001 |
|
|
Смертність, не пов’язана із серцево-судинними захворюваннями, N (%) |
57 (2,4) |
97 (2,1) |
|
Співвідношення ризиків у порівнянні з плацебо (95% ДІ) |
0,84 (0,60; 1,16) |
a Дані, отримані у пацієнтів, що проходили лікування (тобто пацієнтів, які отримали щонайменше одну дозу досліджуваного лікарського засобу).
b Об’єднані дози емпагліфлозину 10 мг і 25 мг.
* Оскільки результати дослідження були включені в проміжний аналіз, застосовується двосторонній довірчий інтервал 95,02%, який відповідає значенням p < 0,0498 для значущості.
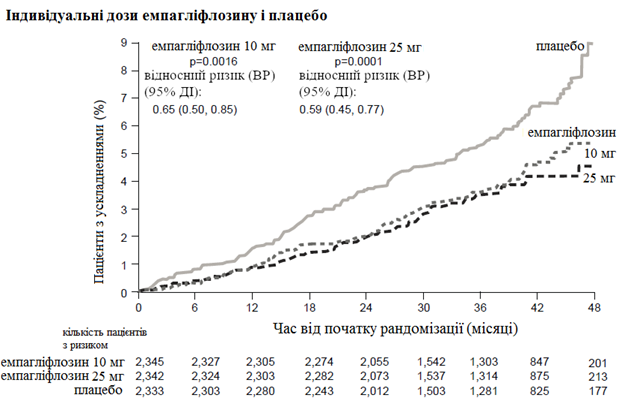
Рис. 1. Час до настання смерті внаслідок серцево-судинних захворювань у дослідженні EMPA-REG OUTCOME.
Серцева недостатність, що вимагає госпіталізації
В ході дослідження EMPA-REG OUTCOME емпагліфлозин знижував ризик розвитку серцевої недостатності, яка потребувала госпіталізації, порівняно з плацебо (група емпагліфлозину – 2,7 %; група плацебо – 4,1 %; ВР 0,65, 95 % ДІ 0,50; 0,85).
Нефропатія
В ході дослідження EMPA-REG OUTCOME при визначенні часу до настання першого епізоду нефропатії ВР становив 0,61 (95 % ДІ 0,53; 0,70) в групі емпагліфлозину (12,7 %) порівняно з групою плацебо (18,8 %).
Крім цього, емпагліфлозин підвищував ризик (ВР 1,82; 95 % ДІ 1,40; 2,37) розвитку стійкої нормо- або мікроальбумінурії (49,7 %) у пацієнтів з макроальбумінурією на початку дослідження порівняно з плацебо (28,8 %).
Серцева недостатність
Застосування емпагліфлозину пацієнтам із серцевою недостатністю та зниженою фракцією викиду
Рандомізоване подвійне сліпе плацебо-контрольоване дослідження (EMPEROR-Reduced) було проведено за участю 3730 пацієнтів із хронічною серцевою недостатністю (клас II-IV за класифікацією Нью-Йоркської кардіологічної асоціації (NYHA)) та зниженою фракцією викиду лівого шлуночка (ФВЛШ ≤40 %) з метою оцінки ефективності та безпеки застосування емпагліфлозину 10 мг 1 раз на добу як доповнення до стандартної терапії серцевої недостатності. Первинною кінцевою точкою був час до першого епізоду підтвердженої серцево-судинної (СС) смерті або госпіталізації з приводу серцевої недостатності (ГСН). Виникнення нахилу зміни підтвердженої ГСН (першої та повторної) та рШКФ (ХХН-EPI) відносно вихідних значень були включені до підтверджуючого випробування. Лікування серцевої недостатності на початку дослідження включало застосування інгібіторів АПФ/ блокаторів рецепторів ангіотензину II/інгібіторів рецепторів ангіотензину-неприлізіну (88,3%), бета-блокаторів (94,7%), антагоністів мінералокортикоїдних рецепторів (71,3%) та діуретиків (95,0%).
1863 пацієнтів було рандомізовано в групу емпагліфлозину 10 мг (плацебо: 1867). Медіана тривалості лікування становила 15,7 місяців. Досліджувана популяція включала 76,1% чоловіків та 23,9% жінок, середній вік яких становив 66,8 років (діапазон: 25-94 років); 26,8% пацієнтів були віком старше 75 років. 70,5% досліджуваної популяції становили пацієнти європеоїдної раси, 18,0% - монголоїдної раси та 6,9% - негроїдної раси/афро-американці. На момент рандомізації 75,1% пацієнтів мали серцеву недостатність II класу за класифікацією NYHA, 24,4% серцеву недостатність ІII класу за класифікацією NYHA та 0,5% - серцеву недостатність IV класу за класифікацією NYHA. Середнє значення ФВЛШ становило 27,5%. На початку дослідження середня рШКФ становила 62,0 мл/хв./1,73 м2, а середнє співвідношення альбумін/креатинін сечі (UACR) - 22 мг/г. Близько у половини пацієнтів (51,7%) рШКФ становила ≥60 мл/хв./1,73 м2, у 24,1% - від 45 до <60 мл/хв./1,73 м2, у 18,6% - від 30 до <45 мл/хв./1,73 м2 та у 5,3% - від 20 до <30 мл/хв./1,73 м2.
Емпагліфлозин продемонстрував найбільшу ефективність щодо зниження ризику первинної комбінованої кінцевої точки - СС смерті або госпіталізації з приводу серцевої недостатності порівняно з плацебо. Крім того, емпагліфлозин значно знижував ризик ГСН (першої та повторної), а також значно знижував швидкість зменшення рШКФ (Таблиця 2; рис. 2).
Таблиця 2
Ефект лікування щодо первинної комбінованої кінцевої точки, її компонентів та двох ключових вторинних кінцевих точок, включених до попередньо визначеного підтверджуючого випробування
|
Плацебо |
Емпагліфлозин 10 мг |
|
|
N |
1867 |
1863 |
|
Час до підтвердженого першого епізоду СС смерті або ГСН, N (%) |
462 (24,7) |
361 (19,4) |
|
Співвідношення ризиків у порівнянні з плацебо (95 % ДІ)* |
0,75 (0,65, 0,86) |
|
|
p−значення для найбільшої ефективності |
<0,0001 |
|
|
СС смерть, N (%)* |
202 (10,8) |
187 (10,0) |
|
Співвідношення ризиків у порівнянні з плацебо (95% ДІ) |
0,92 (0,75, 1,12) |
|
|
ГСН (перший епізод), N (%) |
342 (18,3) |
246 (13,2) |
|
Співвідношення ризиків у порівнянні з плацебо (95% ДІ) |
0,69 (0,59, 0,81) |
|
|
ГСН (перша та повторна), кількість подій |
553 |
388 |
|
Співвідношення ризиків у порівнянні з плацебо (95 % ДІ)* |
0,70 (0,58, 0,85) |
|
|
p−значення |
0,0003 |
|
|
Нахил зміни рШКФ (ХХН EPI)cr, швидкість зниження (мл/хв./1.73м2/рік) |
-2,28 |
-0,55 |
|
Різниця між методами лікування порівняно з плацебо (95 % ДІ) |
1,73 (1,10, 2,37 ) |
|
|
p-значення |
p < 0,0001 |
СС = серцево-судинний, ГСН = госпіталізація з приводу серцевої недостатності, рШКФ = розрахункова швидкість клубочкової фільтрації, ХХН EPI = епідеміологічне вирівнювання при хронічній хворобі нирок
* смерть від серцево-судинного захворювання та госпіталізація з приводу серцевої недостатності були підтверджені незалежним комітетом з клінічних подій та проаналізовані на основі рандомізованого набору
** нахил зміни швидкості клубочкової фільтрації проаналізований на основі обробленого набору. Затримка становила -0,95 мл/хв/1,73 м2 для плацебо та -3,02 мл/хв/1,73 м2 для емпагліфлозину. Затримка являє собою гострий ефект на розрахункову швидкість клубочкової фільтрації тоді, як нахил являє собою довгостроковий ефект.
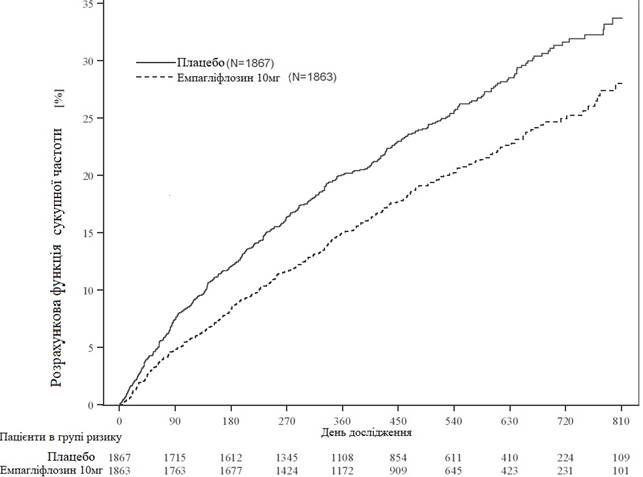
Рис. 2 Час до першої підтвердженої події серцево-судинної смерті або госпіталізації через серцеву недостатність
Результати щодо первинної об’єднаної кінцевої точки загалом відповідали відношенню ризиків (ВР) нижче 1 у всіх попередньо визначених підгрупах, включаючи пацієнтів з серцевою недостатністю, з цукровим діабетом 2 типу або без нього та з порушенням функції нирок або без порушення функції нирок (не нижче розрахункової швидкості клубочкової фільтрації (рШКФ) 20 мл/хв/1,73 м2).
Застосування емпагліфлозину пацієнтам із серцевою недостатністю та збереженою фракцією викиду
Рандомізоване сліпе плацебо-контрольоване дослідження (EMPEROR-Preserved) було проведено за участю 5 988 пацієнтів із хронічною серцевою недостатністю (NYHA II-IV) і збереженою фракцією викиду (ФВЛШ > 40 %) для оцінки ефективності та безпеки застосування емпагліфлозину у дозі 10 мг 1 раз на добу як доповнення до стандартної терапії. Первинною кінцевою точкою був час до першого випадку смерті від серцево-судинного захворювання або підтвердженої госпіталізації з приводу серцевої недостатності (СН). Підтверджена госпіталізація з приводу СН (перша та повторна) та нахил зміни рШКФ (CKD-EPI) від вихідного рівня були включені в підтверджувальне тестування. Базова терапія включала інгібітори АПФ/блокатори рецепторів ангіотензину/інгібітор рецепторів ангіотензину/неприлізину (80,7 %), бета-блокатори (86,3 %), антагоністи мінералокортикоїд-них рецепторів (37,5 %) та діуретики (86,2 %).
Емпагліфлозин продемонстрував найбільшу ефективність щодо зниження ризику первинної кінцевої точки смерті від серцево-судинного захворювання або госпіталізації з приводу серцевої недостатності порівняно з плацебо. Крім того, емпагліфлозин значно знижував ризик виникнення госпіталізації з приводу СН (первинної та повторної) та значно уповільнював швидкість зниження рШКФ (Таблиця 3; рис. 3).
Таблиця 3
Ефект лікування щодо первинної комбінованої кінцевої точки, її компонентів та двох ключових вторинних кінцевих точок, включених до попередньо визначеного підтвердженого випробування
|
Показник |
Плацебо |
Емпагліфлозин, 10 мг |
|
N |
2991 |
2997 |
|
Час до підтвердженого першого епізоду СС смерті або госпіталізації з приводу СН, N (%) |
511 (17,1) |
415 (13,8) |
|
Співвідношення ризиків порівнянно з таким при застосуванні плацебо (95 % ДІ)* |
0,79 (0,69, 0,90) |
|
|
p-значення для найбільшої ефективності |
0,0003 |
|
|
СС смерть, N (%)* |
244 (8,2) |
219 (7,3) |
|
Співвідношення ризиків порівняно з такими при застосуванні плацебо (95 % ДІ) |
0,91 (0,76, 1,09) |
|
|
Госпіталізація з приводу СН (перший епізод), N (%) |
352 (11,8) |
259 (8,6) |
|
Співвідношення ризиків порівняно з такими при застосуванні плацебо (95 % ДІ) |
0,71 (0,60, 0,83) |
|
|
Госпіталізація з приводу СН (перша та повторна), кількість подій |
541 |
407 |
|
Співвідношення ризиків у порівняно з такими при застосуванні плацебо (95 % ДІ)* |
0,73 (0,61, 0,88) |
|
|
p-значення |
0,0009 |
|
|
Нахил зміни рШКФ (ХХН EPI)cr, швидкість зниження (мл/хв/1,73 м2/рік) |
-2,62 |
-1,25 |
|
Різниця між методами лікування порівняно з плацебо (95 % ДІ) |
1,36 (1,06, 1,66 ) |
|
|
p-значення |
р < 0,0001 |
СС – серцево-судинний, СН – серцевої недостатності, рШКФ – розрахункова швидкість клубочкової фільтрації, ХХН EPI – епідеміологічне вирівнювання при хронічній хворобі нирок.
* Смерть від серцево-судинного захворювання та госпіталізація з приводу серцевої недостатності були підтверджені незалежним комітетом з клінічних подій та проаналізовані на основі рандомізованого набору.
** Нахил зміни швидкісті клубочкової фільтрації проаналізованої на основі обробленого набору. Затримка становила - 0,18 мл/хв/1,73 м2 при застосуванні для плацебо та - 3,02 мл/хв/1,73 м2 при застосуванні емпагліфлозину. Затримка являє собою гострий ефект на розрахункову швидкість клубочкової фільтрації тоді, як нахил являє собою довгостроковий ефект.
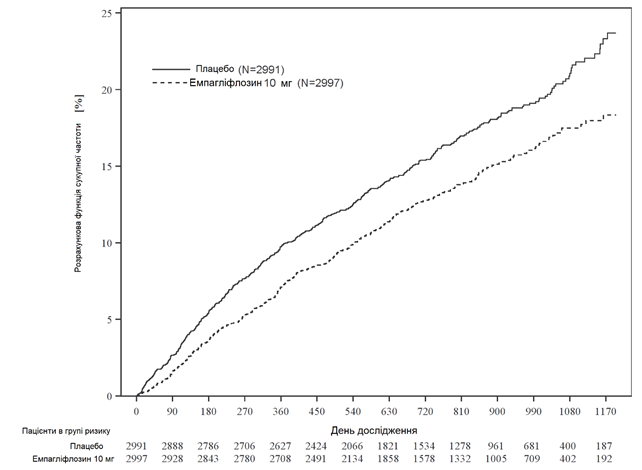
Рис. 3 Час до першої підтвердженої події серцево-судинної смерті або госпіталізації через серцеву недостатність.
Результати первинної комбінованої кінцевої точки були узгоджені в кожній із попередньо визначених підгруп, класифікованих, наприклад, за ФВЛШ, статусом цукрового діабету або функцією нирок (до 20 мл/хв/1,73 м2).
Хронічна хвороба нирок
Рандомізоване подвійно сліпе плацебо-контрольоване дослідження застосування емпагліфлозину в дозі 10 мг один раз на добу (EMPA-KIDNEY) проводилось за участю 6609 пацієнтів із хронічною хворобою нирок (рШКФ ≥ 20 ‒ < 45 мл/хв/1,73 м2 або рШКФ ≥ 45 ‒ < 90 мл/хв/1,73 м2 при співвідношенні альбумін/креатинін сечі (UACR) ≥ 200 мг/г) для оцінки серцево-ниркових результатів як доповнення до стандартної терапії. Первинною кінцевою точкою був час до першого випадку прогресування захворювання нирок (стійке зниження ≥ 40 % рШКФ з моменту рандомізації, стійка рШКФ < 10 мл/хв/1,73 м², термінальна стадія хвороби нирок або смерть від хвороби нирок) чи смерть від СС захворювання. Перший випадок госпіталізації з приводу серцевої недостатності чи смерті від СС захворювання, госпіталізація з будь-якої причини (перша та повторна) та смерть з усіх причин були включені до підтверджуючого випробування.
Лікування на початку дослідження включало застосування інгібітора РАС 85,2 % інгібітора АПФ/ блокатора рецепторів ангіотензину II.
3304 пацієнти були рандомізовані в групу застосування емпагліфлозину в дозі 10 мг (плацебо ‒ 3305). Медіана тривалості лікування становила 24,3 місяця. Досліджувана популяція включала 66,8 % чоловіків та 33,2 % жінок, середній вік яких становив 63,3 року (діапазон 18 ‒ 94 роки), 23,0 % пацієнтів були віком понад 75 років. 58,4 % досліджуваної популяції становили пацієнти європеоїдної раси, 36,2 % – монголоїдної раси та 4,0 % – негроїдної раси/афро-американці.
На початку дослідження середня рШКФ становила 37,3 мл/хв/1,73 м2, у 21,2 % пацієнтів рШКФ становила ≥ 45 мл/хв/1,73 м2, у 44,3 % – від 30 до < 45 мл/хв/1,73 м2 та у 34,5 % – < 30 мл/хв/1,73 м2, включаючи 254 пацієнтів з рШКФ <20 мл/хв/1,73 м2. Середнє співвідношення альбумін/креатинін сечі (UACR) становило 329 мг/г, у 20,1 % пацієнтів UACR становило < 30 мг/г, у 28,2 % – від 30 до ≤ 300 мг/г, у 51,7 % – > 300 мг/г; та у 41,1 % – < 200 мг/г. Основними причинами ХХН були діабетична нефропатія/діабетична хвороба нирок (31 %), гломерулярна хвороба (25%), гіпертонічна хвороба/реноваскулярна хвороба (22 %) та інші/невідомі причини (22 %).
Емпагліфлозин переважав плацебо у зниженні ризику первинної комбінованої кінцевої точки, що включала прогресування захворювання нирок або смерть від СС захворювання (див. таблицю 4). Крім того, емпагліфлозин значно знижував ризик госпіталізації з будь-якої причини (першої та повторної).
Таблиця 4
Ефекти лікування для первинної комбінованої кінцевої точки та ключових вторинних кінцевих точок, включених до попередньо визначеного підтверджувального випробування, та її складових
|
Плацебо |
Емпагліфлозин, 10 мг |
|
|
N |
3 305 |
3 304 |
|
Час до першого прояву прогресування хвороби нирок (стійке зниження рШКФ ≥ 40 % з моменту рандомізації, стійка рШКФ < 10 мл/хв/1,73 м2, термінальна стадія хвороби нирок* (ТСХН) або смерть від хвороби нирок) чи смерть від СС захворювання, N (%) |
558 (16,9) |
432 (13,1) |
|
Співвідношення загроз порівняно з плацебо (99,83 % ДІ) |
0,72 (0,59, 0,89) |
|
|
р-значення для доведення не нижчої ефективності |
<0,0001 |
|
|
Стійке зниження рШКФ ≥ 40% з моменту рандомізації N (%) |
474 (14,3) |
359 (10,9) |
|
Співвідношення загроз порівняно з плацебо (95 % ДІ) |
0,70 (0,61, 0,81) |
|
|
р-значення |
<0,0001 |
|
|
ТСХН* або стійка рШКФ < 10 мл/хв/1,73 м2, N (%) |
221 (6,7) |
157 (4,8) |
|
Співвідношення загроз порівняно з плацебо (95 % ДІ) |
0,69 (0,56, 0,84) |
|
|
р-значення |
0,0003 |
|
|
Смерть від захворювання нирок, N (%)** |
4 (0,1) |
4 (0,1) |
|
Співвідношення загроз порівняно з плацебо (95 % ДІ) |
||
|
р-значення |
||
|
Смерть від СС захворювання, N (%) |
69 (2,1) |
59 (1,8) |
|
Співвідношення загроз порівняно з плацебо (95 % ДІ) |
0,84 (0,60, 1,19) |
|
|
р-значення |
0,3366 |
|
|
ТСХН* або смерть від СС захворювання, N (%)# |
217 (6,6) |
163 (4,9) |
|
Співвідношення загроз порівняно з плацебо (95 % ДІ) |
0.73 (0.59, 0.89) |
|
|
р-значення |
0.0023 |
|
|
Частота госпіталізації з усіх причин (перша та повторна), N подій |
1895 |
1611 |
|
Співвідношення загроз порівняно з плацебо (99,03 % ДІ) |
0,86 (0,75, 0,98) |
|
|
р-значення |
0,0025 |
СС ‒ серцево-судинний, ГСН ‒ госпіталізація з приводу серцевої недостатності, рШКФ ‒ розрахована швидкість клубочкової фільтрації.
* Термінальна стадія хвороби нирок (ТСХН) визначається як початок підтримуючого діалізу або отримання трансплантату нирки.
** Зафіксовано замало випадків смерті від хвороби нирок, щоб розрахувати належне співвідношення загроз.
# Попередньо визначено як один із двох критеріїв зупинки в попередньо запланованому проміжному аналізі
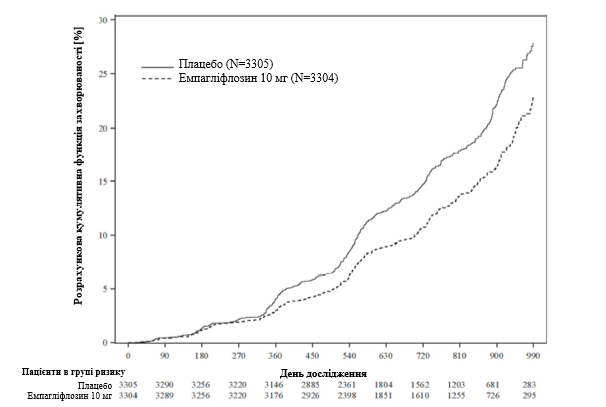
Рис. 4. Час до першого епізоду прогресування захворювання нирок або передбачуваної СС смерті, розрахункова кумулятивна функція захворюваності.
Результати первинної комбінованої кінцевої точки були узгоджені в кожній із попередньо визначених підгруп, класифікованих за рШКФ, основною причиною хвороби нирок, статусом цукрового діабету або застосуванням інгібіторів РАС. Переваги лікування були більш очевидними у пацієнтів з високим рівнем альбумінурії.
Під час лікування рШКФ з часом знижувалася повільніше в групі емпагліфлозину порівняно з групою плацебо. Емпагліфлозин уповільнив річну швидкість зниження рШКФ порівняно з плацебо на 1,37 мл/хв/1,73 м2/рік (95 % ДІ 1,16, 1,59), на основі попереднього аналізу всіх вимірювань рШКФ, зроблених під час 2-місячного візиту до заключний контрольний візит. Пацієнти, які отримували емпагліфлозин, спостерігали початкове зниження рШКФ, яке повернулося до початкового рівня після припинення лікування, як було продемонстровано в кількох дослідженнях емпагліфлозину, підтверджуючи те, що гемодинамічні зміни відіграють роль у гострому впливі емпагліфлозину на рШКФ.
Діти
Цукровий діабет 2 типу
Клінічна ефективність та безпека емпагліфлозину (10 мг з можливим збільшенням дози до 25 мг) та лінагліптину (5 мг) 1 раз на добу вивчалася у дітей і підлітків віком від 10 до 17 років з цукровим діабетом 2 типу в плацебо-контрольованому дослідженні (DINAMO) протягом 26 тижнів з подовженням безпечного періоду до 52 тижнів.
Основне лікування, як доповнення до дієти та фізичних вправ включало метформін (51 %), комбінацію метформіну та інсуліну (40,1 %), інсулін (3,2 %) або жодного (5,7 %).
Скорегована середня зміна HbA1c на 26 тижні між емпагліфлозином (N=52) та плацебо (N=53) – 0,84 % була клінічно та статистично значущою (95 % ДІ -1,50, -0,19; p=0,0116).
Крім того, лікування емпагліфлозином порівняно з плацебо призвело до клінічно значущої скоригованої середньої зміни глюкози в плазмі крові натще – 35,2 мг/дл (95 % ДІ -58,6, -11,7) (-1,95 ммоль/л (-3,25, - 0,65)).
Серцева недостатність та хронічна хвороба нирок
Європейське агентство з лікарських засобів відмовилось від зобов’язання щодо надання результатів досліджень лікарського засобу ДЖАРДІНС в усіх підгрупах дітей з хронічною хворобою нирок та серцевою недостатністю (інформацію про застосування у дітей див. у розділі «Спосіб застосування та дози).
Фармакокінетика.
Всмоктування
Фармакокінетика емпагліфлозину широко описана у здорових добровольців та пацієнтів з цукровим діабетом 2 типу. Після прийому перорально емпагліфлозин швидко поглинався, пікова концентрація в плазмі крові відзначалася при середньому tmax 1,5 години після прийому препарату. Після цього концентрація в плазмі знижувалась двофазно, зі швидкою фазою розподілу та відносно повільною кінцевою фазою. Середні показники площі під кривою «концентрація-час» (AUC) та максимальної концентрації (Cmax) в плазмі крові у стані спокою становили 1870 нмоль/год та 259 нмоль/л для емпагліфлозину 10 мг та 4740 нмоль/год та 687 нмоль/л для емпагліфлозину 25 мг 1 раз на добу. Системна дія емпагліфлозину збільшувалась пропорційно дозі. Фармакокінетичні параметри емпагліфлозину у стані спокою після введення одноразової дози були подібними, що вказує на лінійну фармакокінетику відносно часу. Клінічно достовірної різниці щодо фармакокінетики емпагліфлозину між здоровими добровольцями та пацієнтами з цукровим діабетом 2 типу не було.
Введення емпагліфлозину 25 мг після прийому висококалорійної їжі з високим вмістом жирів обумовило деяке зниження його впливу: AUC знизилась приблизно на 16 %, а Cmax – приблизно на 37 % порівняно з прийомом натще. Цей вплив прийому їжі на фармакокінетику емпагліфлозину не вважається клінічно значущим. Емпагліфлозин можна приймати незалежно від прийому їжі.
Розподіл
Очевидний об’єм розподілу у стані спокою становить 73,8 л. Після введення перорального розчину [14C]-емпагліфлозину здоровим добровольцям розподіл еритроцитів становив приблизно 37 %, а зв’язування з білками плазми – 86 %.
Біотрансформація
Істотні метаболіти емпагліфлозину у плазмі крові людини не виявлялись. Найбільш поширеними метаболітами були три кон’югати глюкуроніду (2-, 3- та 6-O глюкуронід). Системна експозиція кожного метаболіту складала менше ніж 10% від загальної експозиції препарату. Дослідження іn vitro вказують на те, що основним шляхом метаболізму емпагліфлозину у людини є глюкуронідація уридин-5’-дифосфоглюкуроносилтрансферазами UGT2B7, UGT1A3, UGT1A8 та UGT1A9.
Виведення
Очевидний термінальний період напіввиведення емпагліфлозину становить 12,4 години, а очевидний пероральний кліренс – 10,6 л/год. Міжсуб’єктна та залишкова варіабельність для кліренсу перорального емпагліфлозину складала 39,1% та 35,8% відповідно. При застосуванні один раз на добу концентрації емпагліфлозину в плазмі крові у стані спокою досягались до 5-ї дози. Узгоджується з періодом напіввиведення, до 22 % накопичення (відносно AUC у плазмі крові) спостерігалось у стані спокою. Після введення перорального розчину [14C]-емпагліфлозину здоровим добровольцям приблизно 96 % міченої речовини виводилося з калом (41 %) та сечею (54 %). Більша частина міченої речовини у незміненому вигляді виводилася з калом та близько половини міченої речовини у незміненому вигляді виводилося з сечею.
Спеціальні категорії пацієнтів
Пацієнти з нирковою недостатністю
У пацієнтів з легкими, помірними або тяжкими порушеннями функцій нирок (рШКФ < 30-< 90 мл/хв/1,73 м2) та пацієнтів з нирковою недостатністю/термінальною стадією хвороби нирок (ТСХН) AUC емпагліфлозину збільшилась приблизно на 18 %, 20 %, 66 % та 48 % відповідно, порівняно з суб’єктами з нормальною нирковою функцією. Пікові рівні емпагліфлозину у плазмі крові були подібними у пацієнтів з помірними порушеннями функцій нирок та нирковою недостатністю / ТСХН, порівняно з суб’єктами з нормальною функцією нирок. Пікові рівні емпагліфлозину у плазмі крові були приблизно на 20% вищими у пацієнтів з легкими та тяжкими порушеннями функцій нирок, порівняно з суб’єктами з нормальною функцією нирок. З огляду на фармакокінетику у суб’єктів, очевидний пероральний кліренс емпагліфлозину зменшувався зі зниженням рШКФ, що обумовлює підсилення дії препарату.
Пацієнти з печінковою недостатністю
У пацієнтів з легкою, помірною та тяжкою печінковою недостатністю відповідно до класифікації Чайлда – П’ю AUC емпагліфлозину збільшилась приблизно на 23 %, 47 % та 75 %, а Cmax − приблизно на 4 %, 23 % та 48 % відповідно, порівняно з суб’єктами з нормальною функцією печінки.
Індекс маси тіла
Індекс маси тіла не мав клінічно значущого впливу на фармакокінетику емпагліфлозину. AUC була на 5,82 %, 10,4 % та 17,3 % меншою у пацієнтів з ІМТ 30, 35 та 45 кг/м2 відповідно, порівняно з пацієнтами з індексом маси тіла 25 кг/м2.
Стать
Стать не мала клінічно значущого впливу на фармакокінетику емпагліфлозину.
Раса
AUC була на 13,5 % більшою у пацієнтів монголоїдної раси з індексом маси тіла 25 кг/м2 порівняно з пацієнтами інших рас з індексом маси тіла 25 кг/м2.
Пацієнти літнього віку
Вік не мав клінічно значущого впливу на фармакокінетику емпагліфлозину.
Діти
Розпочато клінічні дослідження застосування емпагліфлозину дітям віком 10–18 років з цукровим діабетом 2 типу. Отримані на сьогодні дані з фармакокінетики та фармакодинаміки є порівнянними з такими у дорослих.
Педіатричне дослідження Фази 3 вивчало фармакокінетику та фармакодинаміку (зміна HbA1c від вихідного рівня) емпагліфлозину 10 мг з можливим збільшенням дози до 25 мг у дітей та підлітки від 10 до 17 років з цукровим діабетом 2 типу. Спостережувана співвідношення експозиція-реакція була загалом порівнянною у дорослих, дітей і підлітків. Пероральне застосування емпагліфлозину призвело до експозиції в межах діапазону, що спостерігається у дорослих пацієнтів.
Спостережувані середні геометричні мінімальні концентрації та середні геометричні концентрації через 1,5 години після введення в рівноважному стані становили 26,6 нмоль/л і 308 нмоль/л з емпагліфлозином 10 мг одноразово щодня та 67,0 нмоль/л і 525 нмоль/л з емпагліфлозином 25 мг один раз на день.
Клінічні характеристики.
Показання.
Цукровий діабет 2 типу
ДЖАРДІНС показаний дорослим та дітям віком від 10 років для лікування недостатньо контрольованого цукрового діабету 2 типу як доповнення до дієти та фізичних навантажень:
- як монотерапія, коли застосування метформіну вважається неможливим через непереносимість лікарського засобу;
- на додаток до інших лікарських засобів для лікування діабету.
Результати досліджень щодо комбінації терапій, впливу на глікемічний контроль, серцево-судинних та ниркових подій та досліджуваних популяцій дивіться у розділах «Особливості застосування», «Взаємодія з іншими лікарськими засобами та інші види взаємодій» та «Фармакодинаміка».
Серцева недостатність
ДЖАРДІНС показаний дорослим для лікування симптоматичної хронічної серцевої недостатності.
Хронічна хвороба нирок
ДЖАРДІНС показаний дорослим для лікування хронічної хвороби нирок.
Протипоказання.
Підвищена чутливість до активної речовини або до будь-якої з допоміжних речовин.
Взаємодія з іншими лікарськими засобами та інші види взаємодій.
Фармакодинамічні взаємодії
Діуретики
Емпагліфлозин може посилювати сечогінний ефект тіазидних та петльових діуретиків і може збільшити ризик зневоднення і гіпотонії (див. розділ «Особливості застосування»).
Інсулін та стимулятори секреції інсуліну
Інсулін та стимулятори секреції інсуліну, такі як сульфонілсечовина, можуть збільшити ризик гіпоглікемії. Для зниження ризику гіпоглікемії може бути рекомендоване зниження дози інсуліну або стимулятора секреції інсуліну при застосуванні в комбінації з емпагліфлозином (див. розділи «Спосіб застосування та дози» та «Побічні реакції»).
Фармакокінетичні взаємодії
Вплив інших лікарських засобів на емпагліфлозин
Дані іn vitro вказують на те, що основним шляхом метаболізму емпагліфлозину у людини є глюкуронідація уридин-5’-дифосфоглюкуроносилтрансферазами UGT1A3, UGT1A8, UGT1A9 і UGT2B7. Емпагліфлозин є субстратом транспортерів поглинання у людини OAT3, OATP1B1 і OATP1B3, але не OAT1 і OCT2. Емпагліфлозин є субстратом Р-глікопротеїну (P-gp) та білка резистентності раку молочної залози (BCRP).
Супутнє застосування емпагліфлозину з пробенецидом, інгібітором ферментів уридин- дифосфоглюкуроносилтрансферази (UGT) і OAT3, призвело до підвищення піка концентрації емпагліфлозину в плазмі крові (Cmax) на 26 % і збільшення площі під кривою «концентрація-час» (AUC) на 53 %. Ці зміни не вважалися клінічно значущими.
Вплив індукції UGT (в тому числі індукції рифампіцином або фенітоїном) на емпагліфлозин не вивчався. Супутнє лікування з відомими індукторами ферментів UGT не рекомендується через потенційний ризик зменшення ефективності. Якщо індуктор ферментів UGT повинен бути одночасно введений, моніторинг глікемічного контролю для оцінки реакції на ДЖАРДІНС є доцільним.
Дослідження взаємодії з гемфіброзилом, інгібітором транспортерів OAT3 та OATP1B1/1B3 in vitro, показало, що після супутнього застосування Cmax емпагліфлозину підвищувалася на 15 % та AUC підвищувалась на 59 %. Ці зміни не вважались клінічно значущими.
Інгібування транспортерів OATP1B1/1B3 при супутньому застосуванні з рифампіцином обумовило підвищення Cmax емпагліфлозину на 75 % та підвищення AUC емпагліфлозину на 35 %. Ці зміни не вважались клінічно значущими.
Вплив емпагліфлозину при супутньому застосуванні з верапамілом, інгібітором P-gp, та окремо був подібним. Це вказує на те, що інгібування P-gp не має клінічно значущого впливу на емпагліфлозин.
Дослідження взаємодії, вказують на те, що на фармакокінетику емпагліфлозину не впливає супутнє введення метформіну, глімепіриду, піоглітазону, ситагліптину, лінагліптину, варфарину, верапамілу, раміприлу, симвастатину, торасеміду і гідрохлоротіазиду.
Вплив емпагліфлозину на інші лікарські засоби
Емпагліфлозин може збільшувати виведення літію нирками та знижувати рівень літію у крові. Після початку прийому емпагліфлозину та зміни дози слід частіше контролювати концентрацію літію в сироватці крові. Пацієнт повинен бути направлений до лікаря, який призначив препарати літію, для контролю концентрації літію в сироватці крові.
За даними досліджень in vitro, емпагліфлозин не інгібує, не інактивує та не індукує ізоформи CYP450. Емпагліфлозин не інгібує UGT1A1, UGT1A3, UGT1A8, UGT1A9 або UGT2B7. Міжлікарські взаємодії за участю основних ізоформ CYP450 або UGT з емпагліфлозином і супутньо введеними субстратами цих ферментів вважаються малоймовірними.
Емпагліфлозин не інгібує P-gp у терапевтичних дозах. За даними досліджень in vitro, малоймовірно, що емпагліфлозин спричинить взаємодію з діючими речовинами, що є субстратами P-gp. Супутнє застосування дигоксину, субстрату P-gp, і емпагліфлозину обумовило до 6 % збільшення AUC та 14 % збільшення Cmax дигоксину. Ці зміни не вважалися клінічно значущими.
Емпагліфлозин не інгібує транспортери поглинання у людини, такі як OAT3, OATP1B1 і OATP1B3 in vitro у клінічно значущих концентраціях в сироватці крові, тобто міжлікарська взаємодія з субстратами цих транспортерів поглинання вважається малоймовірною.
Дослідження взаємодії, проведені за участю здорових добровольців, вказують на те, що емпагліфлозин не має клінічно значущого впливу на фармакокінетику метформіну, глімепіриду, піоглітазону, ситагліптину, лінагліптину, симвастатину, варфарину, раміприлу, дигоксину, діуретиків та пероральних контрацептивів.
Діти
Дослідження взаємодії проводилося лише у дорослих.
Особливості застосування.
Загальна інформація
Емпагліфлозин не слід застосовувати пацієнтам із цукровим діабетом 1 типу (див. «Кетоацитоз» у розділі «Особливості застосування»).
Кетоацидоз
У пацієнтів з цукровим діабетом, які застосували інгібітори НЗКТГ-2 (включаючи емпагліфлозин), повідомлялося про випадки кетоацидозу, зокрема про випадки із загрозою для життя та летальні випадки. У кількох випадках кетоацидоз проявлявся атипово, з лише помірним збільшенням рівня глюкози в крові (нижче 14 ммоль/л (250 мг/дл)). Невідомо, чи впливає підвищення дози емпагліфлозину на ймовірність виникнення кетоацитозу. Хоча кетоацидоз менш ймовірний у пацієнтів без цукрового діабету, випадки також були зареєстровані у таких пацієнтів.
Необхідно враховувати ризик кетоацитозу у разі таких неспецифічних симптомів, як нудота, блювання, відсутність апетиту, біль у животі, надмірна спрага, ускладнення дихання, сплутаність свідомості, незвичайна втома або сонливість. При виникненні цих симптомів пацієнтів потрібно негайно перевірити щодо розвитку кетоацидозу незалежно від рівня глюкози в крові.
Якщо у пацієнта підозрюється або діагностовано кетоацидоз, слід негайно припинити застосування емпагліфлозину.
У разі госпіталізації пацієнта для значних хірургічних процедур або у разі виникнення серйозних гострих хвороб лікування потрібно перервати. У цих пацієнтів рекомендується моніторинг кетонів. Вимірювання рівня кетонів в сечі є пріорітетнішим ніж визначення їх у крові. Лікування емпагліфлозином можна відновити, коли рівень кетонів нормалізується і стан пацієнта стабілізується.
Перед початком застосування емпагліфлозину в анамнезі пацієнта слід розглянути чинники, які можуть свідчити про схильність до кетоацидозу.
При застосуванні емпагліфлозину спостерігалися тривалий кетоацидоз і тривала глюкозурія. Кетоацидоз може тривати довше після припинення застосування емпагліфлозину, ніж очікувалося, виходячи з періоду напіввиведення з плазми (див. розділ «Фармакокінетика»). Емпагліфлозин-незалежні фактори, такі як дефіцит інсуліну, можуть сприяти тривалим періодам кетоацидозу.
Високий ризик кетоацидозу можуть мати пацієнти з низькою функцією β-клітин (наприклад, у випадку цукрового діабету 2 типу з низьким рівнем С-пептиду, латентного аутоімунного діабету у дорослих або панкреатиту в анамнезі); пацієнти зі станами, які призводять до обмеження прийому їжі або сильного зневоднення; пацієнти, для яких дозу інсуліну знижують, та пацієнти з підвищеною потребою в інсуліні у зв’язку з гострою хворобою, хірургічним втручанням або зловживанням алкоголем. Цим пацієнтам інгібітори НЗКТГ-2 слід застосовувати з обережністю.
Відновлення терапії інгібіторами НЗКТГ-2 для пацієнтів з кетоацитодом, який спостерігався раніше під час лікування інгібіторами НЗКТГ-2 не рекомендується, якщо точно не встановлено та не усунено інший фактор, що провокує кетоацидоз.
ДЖАРДІНС не слід застосовувати для пацієнтів з цукровим діабетом 1-го типу. Дані з програми клінічного дослідження у пацієнтів з цукровим діабетом 1-го типу показали збільшення частоти кетоацидозу у разі застосування емпагліфлозину у дозах 10 мг та 25 мг як доповнення до інсуліну порівняно з плацебо.
Ниркова недостатність
Через обмежений досвід застосування не рекомендується розпочинати лікування емпагліфлозином пацієнтам з рШКФ < 20 мл/хв/1,73 м2.
У пацієнтів з рШКФ < 60 мл/хв/1,73 м2 добова доза емпагліфлозину становить 10 мг (див. розділ «Спосіб застосування та дози»).
Ефективність емпагліфлозину щодо зниження рівня глюкози залежить від функції нирок і знижується у пацієнтів з рШКФ < 45 мл/хв/1,73 м2 та, ймовірно, відсутня у пацієнтів з
рШКФ < 30 мл/хв/1,73 м2 (див. розділи «Спосіб застосування та дози», «Фармакодинаміка» та «Фармакокінетика»).
Моніторинг функцій нирок
Рекомендується провести оцінку функцій нирок таким чином:
– до початку застосування емпагліфлозину та періодично під час лікування, тобто принаймні 1 раз на рік (див. розділи «Спосіб застосування та дози», «Побічні реакції», «Фармакодинаміка» та «Фармакокінетика»);
– до початку застосування будь-якого супутнього лікарського засобу, що може мати несприятливий вплив на функції нирок.
Застосування пацієнтам із ризиком зменшення об’єму міжклітинної рідини
Зважаючи на механізм дії інгібіторів НЗКТГ-2, осмотичний діурез, що супроводжує глюкозурію, може призвести до незначного зниження артеріального тиску (див. розділ «Фармакодинаміка»). Препарат слід застосовувати з обережністю пацієнтам, для яких зниження артеріального тиску, обумовлене емпагліфлозином, може становити небезпеку, наприклад пацієнтам із серцево-судинними захворюваннями, пацієнтам, які застосовують антигіпертензивні лікарські засоби та мають гіпотонію в анамнезі, або пацієнтам віком від 75 років.
У разі розвитку станів, що можуть призвести до втрати рідини (таких як шлунково-кишкові захворювання), пацієнтам, які отримують емпагліфлозин, рекомендується ретельний моніторинг ступеня зменшення об’єму міжклітинної рідини (наприклад фізичний огляд, вимірювання артеріального тиску, лабораторні тести, включаючи рівень гематокриту) і застосування електролітів. Слід розглянути необхідність тимчасового припинення лікування емпагліфлозином до усунення втрати рідини.
Пацієнти літнього віку
Вплив емпагліфлозину на виведення глюкози з сечею пов’язаний з осмотичним діурезом, що може вплинути на стан гідратації. Пацієнти віком від 75 років мають підвищений ризик зменшення об’єму міжклітинної рідини. Більшість таких пацієнтів, які отримували емпагліфлозин, мали побічні реакції, пов’язані зі зменшенням об’єму міжклітинної рідини, у порівнянні з пацієнтами групи плацебо (див. розділ «Побічні реакції»). Тому необхідна спеціальна увага до об’єму міжклітинної рідини у разі одночасного застосування лікарських засобів, які можуть призвести до його зменшення (наприклад діуретиків, АПФ-інгібіторів).
Ускладнені інфекції сечовивідних шляхів
Були виявлені випадки ускладнень у вигляді інфекцій сечостатевих шляхів, включаючи пієлонефрит та уросепсис, у пацієнтів, які отримували лікування емпагліфлозином (див. розділ «Побічні реакції»). Cлід розглянути необхідність тимчасового припинення лікування емпагліфлозином пацієнтів з ускладненими інфекціями сечовивідних шляхів.
Некротизуючий фасциїт промежини (гангрена Фурн’є)
Були виявлені випадки некротизуючого фасциїту промежини (також відомої як гангрена Фурн’є) у жінок та чоловіків, які приймали інгібітори НЗКГТ-2, включаючи емпагліфлозин. Гангрена Фурн’є – це рідкісна, але серйозна та потенційно небезпечна для життя інфекція, яка вимагає невідкладного хірургічного втручання та призначення антибіотиків.
Пацієнтів слід повідомляти про необхідність терміново звернутись до лікаря, якщо у них виникають такі симптоми, як біль, чутливість, еритема чи набряк в ділянці статевих органів або промежини, що супроводжуються лихоманкою або нездужанням. Слід відмітити, що урогенітальна інфекція або абсцес промежини може передувати некротичному фасциїту. У разі підозри на гангрену Фурн’є препарат ДЖАРДІНС слід відмінити та швидко розпочати лікування (включаючи призначення антибіотиків та хірургічну обробку ураженої зони).
Ампутація нижніх кінцівок
Під час тривалих клінічних досліджень з іншим інгібітором НЗКТГ-2 спостерігалося збільшення випадків ампутації нижніх кінцівок (в першу чергу пальця ноги). Невідомо, чи є цей ефект загальним для відповідного класу лікарських засобів. Необхідно порадити пацієнтам з цукровим діабетом проводити профілактичне лікування захворювань стоп.
Ураження печінки
Під час клінічних досліджень були повідомлення про ураження печінки при застосуванні емпагліфлозином. Причинно-наслідковий зв’язок між емпагліфлозином і ураженням печінки не встановлений.
Підвищений гематокрит
Підвищення гематокриту спостерігається під час лікування емпагліфлозином (див. розділ «Побічні реакції»). Пацієнти з вираженим підвищенням гематокриту повинні перебувати під наглядом і досліджуватися на наявність основного гематологічного захворювання.
Хронічна хвороба нирок
Пацієнти з альбумінурією можуть отримати більше користі від лікування емпагліфлозином.
Інфільтративна хвороба або кардіоміопатія такоцубо
Застосування емпагліфлозину пацієнтам з інфільтративною хворобою або з кардіоміопатією такоцубо спеціально не вивчалося. Тому ефективність для таких пацієнтів не встановлена.
Лабораторні аналізи сечі
У пацієнтів, що приймають ДЖАРДІНС тест на глюкозу в сечі буде позитивним у зв’язку з механізмом дії препарату.
Інтерференція з вмістом 1,5-ангідроглюцитолу (1,5-АГ)
Моніторинг глікемічного контролю з вмістом 1,5-АГ не рекомендується, оскільки вимірювання 1,5-АГ недостовірні при оцінці глікемічного контролю у пацієнтів, які приймають інгібітори НЗКТГ-2. Рекомендується використовувати альтернативні методи глікемічного контролю.
Лактоза
Цей лікарський засіб містить лактозу. Пацієнтам з рідкісною спадковою непереносимістю галактози, загальною лактазною недостатністю або глюкозо-галактозною мальабсорбцією не слід приймати цей лікарський засіб.
Натрій
Одна таблетка лікарського засобу містить менше ніж 1 ммоль натрію (23 мг), тобто цей лікарський засіб майже вільний від натрію.
Застосування у період вагітності або годування груддю.
Вагітність
Даних щодо застосування емпагліфлозину вагітним жінкам немає. Дослідження на тваринах показують, що емпагліфлозин дуже обмеженою мірою проникає крізь плаценту на пізніх термінах вагітності, але не вказують на прямий чи непрямий шкідливий вплив на ранній ембріональний розвиток. Однак дослідження на тваринах показали негативний вплив на постнатальний розвиток. Як запобіжний захід бажано уникати застосування препарату ДЖАРДІНС у період вагітності.
Період годування груддю
Невідомо, чи проникає емпагліфлозин у грудне молоко людини. Наявні дані токсикологічних досліджень на тваринах продемонстрували, що емпагліфлозин проникає в молоко. Ризик для новонароджених/немовлят не може бути виключений.
Препарат ДЖАРДІНС не слід застосовувати під час годування груддю.
Репродуктивна функція
Дослідження впливу препарату ДЖАРДІНС на фертильність людини не проводились. Дослідження емпагліфлозину на тваринах не виявили прямого чи непрямого шкідливого впливу на фертильність.
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами.
Препарат ДЖАРДІНС має незначний вплив на здатність керувати транспортними засобами і працювати з іншими механізмами. Проте пацієнтів слід інформувати про ризик гіпоглікемії, якщо ДЖАРДІНС застосовують у поєднанні з препаратами сульфонілсечовини та/або інсуліном.
Спосіб застосування та дози.
Дозування
Цукровий діабет 2 типу
Рекомендована початкова доза становить 10 мг емпагліфлозину 1 раз на добу як монотерапія або у складі комбінованої терапії з іншими лікарськими засобами, що застосовуються при цукровому діабеті. Для пацієнтів, які добре переносять емпагліфлозин у дозі 10 мг 1 раз на добу та які мають рШКФ ≥ 60 мл/хв/1,73 м2 і потребують більш суворого глікемічного контролю, дозу можна збільшити до 25 мг 1 раз на добу. Максимальна добова доза становить 25 мг (див. інформацію нижче і розділ «Особливості застосування»).
Серцева недостатність
Рекомендована доза становить 10 мг емпагліфлозину 1 раз на добу.
Хронічна хвороба нирок
Рекомендована доза становить 10 мг емпагліфлозину 1 раз на добу.
Всі показання
Коли емпагліфлозин застосовують у комбінації з сульфонілсечовиною або інсуліном, слід розглянути можливість застосування сульфонілсечовини або інсуліну в низьких дозах, для того щоб зменшити ризик гіпоглікемії (див. розділи «Взаємодія з іншими лікарськими засобами та інші види взаємодій» і «Побічні реакції»).
У разі пропуску дози її слід прийняти, як тільки пацієнт згадає, проте не слід приймати подвійну дозу препарату в один і той же день.
Особливі групи пацієнтів
Пацієнти з нирковою недостатністю
Через обмежений досвід не рекомендується розпочинати лікування емпагліфлозином у пацієнтів з рШКФ < 20 мл/хв/1,73 м2.
У пацієнтів з рШКФ < 60 мл/хв/1,73 м2 добова доза емпагліфлозину становить 10 мг.
У пацієнтів із цукровим діабетом 2-го типу ефективність емпагліфлозину щодо зниження рівня глюкози знижується при рШКФ < 45 мл/хв/1,73 м2 та, ймовірно, відсутня при рШКФ <30 мл/хв/1,73 м2. Таким чином, якщо рШКФ нижче 45 мл/хв/1,73 м2, у разі необхідності слід розглянути питання про додаткове цукрознижуюче лікування (див. розділи «Особливості застосування», «Побічні реакції», «Фармакодинаміка» та «Фармакокінетика»).
Пацієнти з печінковою недостатністю
Пацієнтам з печінковою недостатністю коригування дози не потрібне. Дія емпагліфлозину підсилюється у пацієнтів з тяжкою печінковою недостатністю. Досвід застосування емпагліфлозину пацієнтам з тяжкою печінковою недостатністю обмежений, тому цей препарат не рекомендується застосовувати цій категорії пацієнтів (див. розділ «Фармакологічні властивості»).
Пацієнти літнього віку
Коригування дози, обумовлене віком пацієнта, не потрібне. У пацієнтів віком від 75 років слід враховувати підвищений ризик зменшення об’єму міжклітинної рідини (див. розділи «Особливості застосування», «Побічні реакції»).
Спосіб застосування
Таблетки можна приймати з їжею або без їжі, запиваючи водою, не розжовуючи.
Діти.
Рекомендована початкова доза становить 10 мг емпагліфлозину 1 раз на добу. Для пацієнтів, які добре переносять емпагліфлозин у дозі 10 мг 1 раз на добу і потребують додаткового контролю глікемії, доза може бути збільшена до 25 мг 1 раз на добу (див. розділи «Фармакодинаміка» та «Фармакокінетика»). Немає даних щодо дітей із рШКФ < 60 мл/хв/1,73 м² і дітей віком до 10 років.
Безпека та ефективність застосування емпагліфлозина для лікування серцевої недостатності або для лікування хронічної хвороби нирок дітям (віком до 18 років) не вивчалася. Препарат не застосовують цій категорії пацієнтів.
Передозування.
Симптоми
В ході контрольованих клінічних досліджень разові дози до 800 мг емпагліфлозину у здорових добровольців і декілька щоденних доз до 100 мг емпагліфлозину у пацієнтів з цукровим діабетом 2 типу не обумовили жодної токсичності. Емпагліфлозин збільшував виведення глюкози з сечею, що призводило до збільшення об’єму сечі. Виявлене збільшення об’єму сечі не залежало від дози і не було клінічно значущим. Досвіду застосування людині доз вище 800 мг немає.
Лікування
У разі передозування слід розпочати лікування відповідно до клінічного стану пацієнта. Виведення емпагліфлозину шляхом гемодіалізу не вивчалось.
Побічні реакції.
Резюме профілю безпеки
Цукровий діабет 2 типу
Загалом 15 582 пацієнти з діабетом 2 типу були включені в клінічні дослідження для оцінки безпеки емпагліфлозину, з яких 10 004 пацієнти отримували емпагліфлозин окремо або в комбінації з метформіном, сульфонілсечовиною, піоглітазоном, інгібіторами DPP-4 або інсуліном.
У 6 плацебо-контрольованих дослідженнях тривалістю від 18 до 24 тижнів було включено 3534 пацієнтів, з яких 1183 отримували плацебо, а 2351 емпагліфлозин. Загальна частота побічних ефектів у пацієнтів, які отримували емпагліфлозин, була подібною до плацебо (див. опис деяких побічних реакцій).
Найбільш частою побічною реакцією була гіпоглікемія при застосуванні з сульфонілсечовиною або інсуліном.
Серцева недостатність
В дослідженнях EMPEROR взяли участь пацієнти з серцевою недостатністю та зниженою фракцією викиду лівого шлуночка (N = 3 726) та збереженою фракцією викиду (N = 5 985), які приймали емпагліфлозин 10 мг або плацебо. Приблизно половина з цих пацієнтів мали цукровий діабет 2 типу. Найчастішою побічною реакцією за об’днаними даними досліджень EMPEROR-Reduced та EMPEROR-Preserved була гіповолемія (емпагліфлозин 10 мг: 11,4 %, плацебо: 9,7 %).
Хронічна хвороба нирок
У дослідження EMPA-KIDNEY були включені пацієнти з хронічною хворобою нирок (N = 6 609), які отримували 10 мг емпагліфлозину або плацебо. Близько 44 % хворих страждали на цукровий діабет 2-го типу.
Найбільш частими побічними реакціями у дослідженні EMPA-KIDNEY була подагра (емпагліфлозин 7,0 % проти плацебо 8,0 %) та гостре ураження нирок (емпагліфлозин 2,8 % проти плацебо 3,5 %), про які частіше повідомлялося у пацієнтів, які приймали плацебо.
Загальний профіль безпеки лікарського засобу ДЖАРДІНС, як правило, відповідав всім досліджуваним показанням до застосування.
Побічні реакції, що виникали у пацієнтів, які отримували емпагліфлозин в ході плацебо-контрольованих досліджень, представлені у таблиці 5.
Побічні реакції класифіковані за системами органів (згідно з MedDRA) та частотою виникнення. Частота виникнення визначається як дуже часті (> 1/10), часті (> 1/100-< 1/10), нечасті (> 1/1000-< 1/100), поодинокі (> 1/10 000 - < 1/1000) або рідкісні (< 1/10 000) та невідомі (не можна оцінити на основі наявних даних).
Таблиця 5
Побічні реакції (за даними плацебо-контрольованих досліджень)
|
Класи системи органів |
Дуже часті |
Часті |
Нечасті |
Поодинокі |
Рідкісні |
|
Інфекції та інвазії |
Вагінальний кандидоз, вульвовагініт, баланіт та інші інфекції статевих органівa, інфекції сечовивідних шляхів (включаючи пієлонефрити та уросепсис)a |
Некротизуючий фасциїт промежини (гангрена Фурн’є) * |
|||
|
Порушення обміну речовин і системи травлення |
Гіпоглікемія (при застосуванні з препаратами сульфонілсечовини або інсуліном)a |
Відчуття спраги |
Кетоацидоз* |
||
|
Шлунково-кишкові розлади |
Закреп |
||||
|
Розлади з боку шкіри та підшкірної клітковини |
Свербіж (загальний), висип |
Кропив’ян-ка, ангіоедема |
|||
|
Розлади з боку судин |
Зменшення об’єму міжклітинної рідини a |
||||
|
Розлади з боку нирок та сечовивідних шляхів |
Підвищене виділення сечіa |
Дизурія |
Тубулоінтерс-тиціальний нефрит |
||
|
Дослідження |
Збільшення ліпідів сироватки кровіa |
Підвищення рівня креатиніну в крові/ зниження швидкості клубочкової фільтраціїa, збільшення гематокри-ту a |
a Додаткову інформацію див. у підрозділах нижче.
* Див. розділ «Особливості застосування».
Опис деяких побічних реакцій
Гіпоглікемія
Частота гіпоглікемії залежала від фонової терапії під час відповідних досліджень та була подібною у разі застосування емпагліфлозину і плацебо як монотерапії, як доповнення до метформіну, як доповнення до піоглітазону з метформіном або без нього, як доповнення до лінагліптину та метформіну, а також у разі застосування комбінації емпагліфлозину з метформіном пацієнтам, що вперше отримували лікування, порівняно з пацієнтами, які застосовували емпагліфлозин і метформін як окремі компоненти раніше. Підвищення частоти легкої гіпоглікемії спостерігалось при введенні емпагліфлозину і плацебо як доповнення до метформіну та сульфонілсечовини (емпагліфлозин у дозі 10 мг - 16,1 %, емпагліфлозин у дозі 25 мг - 11,5 %, плацебо - 8,4 %) та як доповнення до базального інсуліну з метформіном або без нього та з препаратом сульфонілсечовини або без нього (емпагліфлозин у дозі 10 мг - 19,5 %, емпагліфлозин у дозі 25 мг - 28,4 %, плацебо - 20,6 % під час перших 18 тижнів лікування, коли дозу інсуліну не можна було скоригувати, емпагліфлозин у дозі 10 мг - 36,1 %, емпагліфлозин у дозі 25 мг - 36,1 %, плацебо - 35,3 % у ході 78-тижневого дослідження), а також як доповнення до інсуліну у дозованому шприці з метформіном або без нього (емпагліфлозин у дозі 10 мг - 39,8 %, емпагліфлозин у дозі 25 мг - 41,3 %, плацебо - 37,2 % під час перших 18 тижнів лікування, коли дозу інсуліну не можна було скоригувати, емпагліфлозин у дозі 10 мг - 51,1 %, емпагліфлозин у дозі 25 мг - 57,7 %, плацебо - 58 % у ході 52-тижневого дослідження).
У дослідженнях EMPEROR щодо серцевої недостатності подібну частоту гіпоглікемії відзначали при додаванні препарату до сульфонілсечовини або інсуліну (емпагліфлозин 10 мг: 6,5 %, плацебо: 6,7 %).
Тяжка гіпоглікемія (гіпоглікемія, що потребує лікування)
Підвищення частоти тяжкої гіпоглікемії не спостерігалось при застосуванні емпагліфлозину порівняно з плацебо як монотерапії, як доповнення до метформіну, як доповнення до метформіну та препарату сульфонілсечовини і доповнення до піоглітазону з метформіном або без нього, як доповнення до лінагліптину та метформіну, а також як доповнення до стандартної терапії у разі застосування комбінації емпагліфлозину з метформіном пацієнтам, що вперше отримували лікування, порівняно з пацієнтами, які застосовували емпагліфлозин і метформін як окремі компоненти раніше. Підвищення частоти тяжкої гіпоглікемії спостерігалось при введенні емпагліфлозину і плацебо як доповнення до базального інсуліну з метформіном або без нього та з препаратом сульфонілсечовини або без нього (емпагліфлозин у дозі 10 мг - 0 %, емпагліфлозин у дозі 25 мг - 1,3 %, плацебо - 0 % під час перших 18 тижнів лікування, коли дозу інсуліну не можна було скоригувати; емпагліфлозин у дозі 10 мг - 0 %, емпагліфлозин у дозі 25 мг - 1,3 %, плацебо - 0 % у ході 78-тижневого дослідження) та як доповнення до інсуліну у дозованому шприці з метформіном або без нього (емпагліфлозин у дозі 10 мг - 0,5 %, емпагліфлозин у дозі 25 мг - 0,5 %, плацебо - 0,5 % під час перших 18 тижнів лікування, коли дозу інсуліну не можна було скоригувати; емпагліфлозин у дозі 10 мг - 1,6 %, емпагліфлозин у дозі 25 мг - 0,5 %, плацебо - 1,6 % у ході 52-тижневого дослідження).
У дослідженнях EMPEROR щодо серцевої недостатності спостерігалася серйозна гіпоглікемія з однаковою частотою у хворих на цукровий діабет при лікуванні емпагліфлозином та плацебо як доповнення до сульфонілсечовини або інсуліну (емпагліфлозин 10 мг: 2,2 %, плацебо: 1,9 %).
Вагінальний кандидоз, вульвовагініт, баланіт та інші інфекції статевих органів
Вагінальний кандидоз, вульвовагініт, баланіт та інші інфекції статевих органів виникали частіше у разі застосування емпагліфлозину (емпагліфлозин у дозі 10 мг - 4,0 %, емпагліфлозин у дозі 25 мг - 3,9 %) порівняно з плацебо (1,0 %). Ці інфекції виникали частіше у жінок, що отримували емпагліфлозин, порівняно з такими у групі плацебо; у чоловіків різниця у частоті була менш вираженою. Інфекції статевих шляхів були легкими або помірними за інтенсивністю.
У дослідженнях EMPEROR щодо серцевої недостатності частота даних інфекцій була більш вираженою у пацієнтів з цукровим діабетом 2 типу (емпагліфлозин 10 мг: 2,3 %, плацебо: 0,8 %) ніж у пацієнтів без цукрового діабету (емпагліфлозин 10 мг: 1,7 %, плацебо: 0,7 %) при лікуванні емпагліфлозином порівняно з плацебо.
Повідомлялося про випадки фімозу/набутого фімозу, які супроводжувалися інфекціями статевих органів, і в деяких випадках вимагалося обрізання.
Підвищене виділення сечі
Підвищене виділення сечі (включаючи попередньо визначені терміни − полакіурія, поліурія і ніктурія) частіше спостерігалось у пацієнтів, що отримували емпагліфлозин (емпагліфлозин у дозі 10 мг - 3,5 %, емпагліфлозин у дозі 25 мг - 3,3 %), порівняно з пацієнтами групи плацебо (1,4 %). Підвищене виділення сечі було здебільшого легким або помірним за інтенсивністю. Частота випадків ніктурії була схожою при прийомі плацебо та емпагліфлозину (< 1 %).
У дослідженнях EMPEROR щодо серцевої недостатності посилене сечовипускання спостерігалося з подібною частотою у пацієнтів, які отримували емпагліфлозин та плацебо (емпагліфлозин 10 мг: 0,9 %, плацебо: 0,5 %).
Інфекції сечовивідних шляхів
Загальна частота інфекцій сечовивідних шляхів, про які повідомлялося як про небажані явища, була подібною у пацієнтів, що отримували емпагліфлозин у дозі 25 мг та плацебо (7,0 % та 7,2 %), та вищою при застосуванні емпагліфлозину у дозі 10 мг (8,8 %). У порівнянні з плацебо, інфекції сечовивідних шляхів частіше виникали при застосуванні емпагліфлозину у пацієнтів з хронічними або рецидивуючими інфекціями сечовивідних шляхів в анамнезі. Інтенсивність (легка, помірна, тяжка) інфекцій сечовивідних шляхів була подібною у пацієнтів, що отримували емпагліфлозин та плацебо. Інфекції сечовивідних шляхів виникали частіше у жінок, що отримували емпагліфлозин, порівняно з плацебо; у чоловіків різниці не було.
Зменшення об’єму міжклітинної рідини
Загальна частота зменшення об’єму міжклітинної рідини (включаючи попередньо визначені терміни − зниження артеріального тиску (амбулаторно), зниження систолічного артеріального тиску, зневоднення, артеріальна гіпотензія, гіповолемія, ортостатична гіпотонія і непритомність) була подібною у пацієнтів, що отримували емпагліфлозин (емпагліфлозин у дозі 10 мг - 0,6 %, емпагліфлозин у дозі 25 мг - 0,4 %) та плацебо (0,3 %). Частота випадків зменшення об’єму міжклітинної рідини була підвищеною у пацієнтів віком від 75 років, що отримували емпагліфлозин у дозі 10 мг (2,3 %) або емпагліфлозин у дозі 25 мг (4,3 %), порівняно з плацебо (2,1 %).
Підвищення рівня креатиніну в крові/ зниження швидкості клубочкової фільтрації
Загальна частота підвищення рівня креатиніну в крові і зниження швидкості клубочкової фільтрації була подібною у разі застосування емпагліфлозину і плацебо (підвищення рівня креатиніну в крові: емпагліфлозин в дозі 10 мг - 0,6 %, емпагліфлозин в дозі 25 мг - 0,1 %, плацебо - 0,5 %; зниження швидкості клубочкової фільтрації: емпагліфлозин в дозі 10 мг - 0,1 %, емпагліфлозин в дозі 25 мг - 0 %, плацебо - 0,3 %).
Як правило, у пацієнтів, які отримували емпагліфлозин, при тривалому лікуванні початкове підвищення рівня креатиніну і зниження розрахункової швидкості клубочкової фільтрації були тимчасовими або оборотними після припинення терапії.
У ході дослідження EMPA-REG OUTCOME у пацієнтів, які приймали емпагліфлозин, спостерігалось початкове зниження рШКФ (середнє значення - 3 мл/хв/1,73 м2). Після цього рШКФ залишалась стабільною протягом безперервного лікування. Середня рШКФ поверталась до початкових значень після припинення лікування, що свідчить про те, що тяжкі порушення гемодинаміки можуть відігравати певну роль у цих змінах функції нирок. Це явище також спостерігається у дослідженні щодо серцевої недостатності EMPEROR та дослідженні EMPA-KIDNEY.
Підвищення рівня ліпідів у сироватці крові
Середній відсоток збільшення від вихідного рівня для емпагліфлозину на 10 мг та 25 мг порівняно з плацебо відповідно становив 4,9 %, загального холестерину 5,7 % проти 3,5 %; ЛПВЩ - холестерину 3,3 % та 3,6 % проти 0,4 %; ЛПНЩ - холестерин 9,5 % та 10,0 % проти 7,5 %, тригліцериди 9,2 % та 9,9 % проти 10,5 %.
Збільшення гемокриту
Середні зміни гемокриту від вихідного рівня становили 3,4 % та 3,6 % для емпагліфлозину 10 мг та 25 мг порівняно з 0,1 % для плацебо. У дослідженні EMPA-REG OUTCOME показники гемокриту повернулися до вихідних значень через 30 днів після припинення лікування.
Діти
У дослідженні DINAMO лікували 157 дітей віком від 10 років із цукровим діабетом 2 типу, з яких 52 пацієнти отримували емпагліфлозин, 52 пацієнти отримували лінагліптин та 53 пацієнти отримували плацебо (див. розділ «Фармакодинаміка»). Під час плацебо-контрольованої фази найчастішою побічною реакцією на лікарський засіб була гіпоглікемія з вищим загальним показником для пацієнтів у групі емпагліфлозину порівняно з групою плацебо (емпагліфлозин 10 мг і 25 мг, сукупно: 23,1 %, плацебо: 9,4 %). Жоден з цих випадків не був обтяжений та не потребував допомоги.
Загалом профіль безпеки у дітей був аналогічним тому, що спостерігався у дорослих з цукровим діабетом 2 типу.
Повідомлення про підозрювані побічні реакції
Повідомлення про побічні реакції після реєстрації лікарського засобу має важливе значення. Це дає змогу проводити моніторинг співвідношення користь/ризик при застосуванні цього лікарського засобу. Медичним та фармацевтичним працівникам, а також пацієнтам або їхнім законним представникам слід повідомляти про усі випадки підозрюваних побічних реакцій та відсутності ефективності лікарського засобу через Автоматизовану інформаційну систему з фармаконагляду за посиланням: https://aisf.dec.gov.ua.
Термін придатності. 3 роки.
Умови зберігання.
Зберігати в оригінальній упаковці при температурі не вище 25°С. Зберігати в недоступному для дітей місці.
Упаковка.
По 10 таблеток у перфорованому блістері; по 1 або 3 блістери у картонній коробці.
Категорія відпуску. За рецептом.
Виробник.
Берінгер Інгельхайм Фарма ГмбХ і Ко. КГ, Німеччина/ Boehringer Ingelheim Pharma GmbH & Co.KG, Germany
або
Роттендорф Фарма ГмбХ, Німеччина/Rottendorf Pharma GmbH, Germany.
Місцезнаходження виробника та адреса місця провадження його діяльності.
Бінгер Штрассе 173, 55216, Інгельхайм на Рейні, Німеччина/ Binger Strasse 173, 55216, Ingelheim am Rhein, Germany
або
Остенфельдер Штрассе 51-61, 59320 Еннігерлох, Німеччина/ Ostenfelder Strasse 51-61, 59320 Ennigerloh, Germany.
| Назва | Ціна ₴ |
|---|---|
| Джардінс таблетки по 10 мг №30 (3 блістери х 10 таблеток) | 842.60 ₴ |




