Сульбактомакс порошок д/ин. 1000 мг / 500 мг (флакон)
- Все о товаре
- Цены в аптеках
- Аналоги (от 70.60 ₴)
- Отзывы
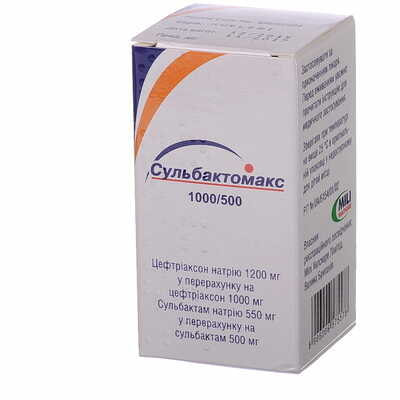



Сульбактам: 500 мг/флакон, Цефтриаксон: 1000 мг/флакон
Сульбактам: 500 мг/флакон, Цефтриаксон: 1000 мг/флакон
Частые вопросы
Цены на Сульбактомакс порошок д/ин. 1000 мг / 500 мг (флакон) начинаются от 262.50 ₴ за упаковку.
По назначению врача. Детальнее необходимо проконсультироваться с вашим лечащим врачом.
Полными аналогами Сульбактомакс порошок д/ин. 1000 мг / 500 мг (флакон) являются:
Страна производитель у Сульбактомакс порошок д/ин. 1000 мг / 500 мг (флакон) - Индия.
Производителем Сульбактомакс порошок д/ин. 1000 мг / 500 мг (флакон) является Венус Ремедис Лимитед.

